题目内容
17.三氟化溴溶于水可发生反应3BrF3+5H2O→HBrO3+Br2+9HF+O2↑,下列说法正确的是( )| A. | 氧化产物是O2 | |
| B. | BrF3既是氧化剂又是还原剂 | |
| C. | 当有5mol水参加反应,生成22.4L氧气 | |
| D. | 当反应中转移3NA个电子时,有NA个水分子被氧化 |
分析 3BrF3+5H2O=HBrO3+Br2↑+O2↑+9HF中,Br元素的化合价由+3价升高为+5价,O元素的化合价由-2价升高为0,Br元素的化合价由+3价降低为0,以此来解答.
解答 解:A.Br元素的化合价由+3价升高为+5价,O元素的化合价由-2价升高为0,则氧化产物是HBrO3、O2,故A错误;
B.Br元素的化合价既升高又降低,则BrF3既是氧化剂又是还原剂,故B正确;
C.没有说明是否是标准状况下,无法计算气体的体积,故C错误;
D.反应中转移6mol电子时有2mol水被氧化,所以当反应中转移3NA个电子时,有NA个水分子被氧化,故D正确.
故选BD.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,注意Br元素的化合价判断为易错点,题目难度不大.

练习册系列答案
相关题目
8. 下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
 下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )
下列各物质中,不能按如图(“→”表示一步完成)关系相互转化的是( )| 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | Cl2 | NaClO | NaCl |
| C | Si | SiO2 | H2SiO3 |
| D | HNO3 | NO | NO2 |
| A. | A | B. | B | C. | C | D. | D |
5.不同的金属在冶炼方法上也有所不同,下列说法正确的是( )
| A. | 钒、铬、锰、铁等难熔金属通常采用铝热法炼制 | |
| B. | 炼钢和炼铁都是采用还原剂将铁从其化合物中还原出来,区别在于炼钢时选用的还原剂的还原性更强 | |
| C. | 由于钠、镁、铝等金属化学性质太活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质 | |
| D. | 炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳 |
2.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.说法正确的是( )
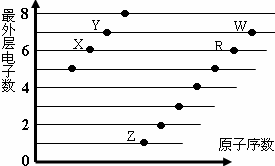

| A. | 元素非金属性:X>R>W | |
| B. | X与R形成的分子内含两种作用力 | |
| C. | X、Z形成的化合物中可能含有共价键 | |
| D. | 元素对应的离子半径:W>R>X |
9.X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素.X和R属同族元素;Z和U位于第VII A族;X和Z可形成化合物XZ4;Q原子的s轨道和p轨道的电子总数相等;T的一种单质在空气中能够自燃.
完成下列填空:
(1)R原子的电子排布式是1s22s22p63s23p2;X所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3;Z的氢化物的水溶液可用于雕刻玻璃;Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是Si>Mg>Cl2.
(2)CuSO4能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是10CuSO4+P4+16H2O→4H3PO4+10Cu+10H2SO4.
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀.工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含FeO),充分搅拌使之溶解.
(3)除去该溶液中杂质离子的方法是在溶液中通入Cl2,再加入CuO粉末调节pH为4~5.
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
(4)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是硅烷中的Si-Si键和Si-H键的键能小于烷烃分子中C-C键和C-H键的键能,稳定性差,易断裂,导致长链硅烷难以形成.
第三周期部分元素氟化物的熔点如下:
(5)表中三种氟化物熔点差异的原因是NaF与MgF2为离子晶体,而SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高;又因为Mg2+的半径小于Na+的半径,所以MgF2中离子键的强度大于NaF中离子键的强度,故MgF2的熔点高于NaF.
完成下列填空:
(1)R原子的电子排布式是1s22s22p63s23p2;X所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3;Z的氢化物的水溶液可用于雕刻玻璃;Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是Si>Mg>Cl2.
(2)CuSO4能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是10CuSO4+P4+16H2O→4H3PO4+10Cu+10H2SO4.
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀.工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含FeO),充分搅拌使之溶解.
(3)除去该溶液中杂质离子的方法是在溶液中通入Cl2,再加入CuO粉末调节pH为4~5.
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能(KJ/mol) | 356 | 413 | 226 | 318 |
第三周期部分元素氟化物的熔点如下:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA | |
| B. | 常温常压下,1 L0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| C. | 1 mol有机物 中最多有6 NA个原子在一条直线上 中最多有6 NA个原子在一条直线上 | |
| D. | 1 mol甲基( 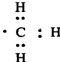 )所含的电子数为7 NA )所含的电子数为7 NA |
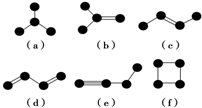 如图是由4个碳原子结合成的6种有机物(氢原子没有画出).
如图是由4个碳原子结合成的6种有机物(氢原子没有画出).
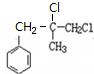 .
. +2NaOH $→_{△}^{水}$
+2NaOH $→_{△}^{水}$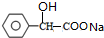 +NaCl+H2O.其反应类型为水解反应、中和反应.
+NaCl+H2O.其反应类型为水解反应、中和反应.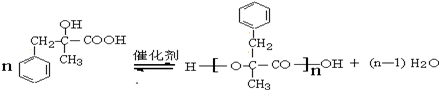 .
. ,而不是
,而不是 或
或 的原因是因为该条件下与双键相连的甲基上的氢原子更易取代.
的原因是因为该条件下与双键相连的甲基上的氢原子更易取代.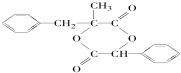 .
.