题目内容
16.历史上曾用“地康法”制Cl2,这一方法是用CuCl2做催化剂,在450°条件下,利用氯化氢与空气中的氧气反应制备Cl2,反应的化学方程式为4HCl+O2$\frac{\underline{\;CuCl_{2}\;}}{450℃}$2Cl2↑+2H2O,这样制得的Cl2中含有一些杂质气体,它们是氧气和氯化氢,将混合气体通过饱和食盐水以回收HCl.分析 用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,生成氯气和水,据此书写方程式,氯化氢易溶于水、氯气在饱和食盐水中溶解度很小,据此选择除杂试剂.
解答 解:用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气,生成氯气和水,配平书写化学方程式为:4HCl+O2$\frac{\underline{\;CuCl_{2}\;}}{450℃}$2Cl2↑+2H2O,制备的氯气中含有为完全反应的氧气和氯化氢,氯化氢易溶于水、氯气在饱和食盐水中溶解度很小,可以选饱和食盐水除去氯气中的氯化氢并回收氯化氢,
故答案为:4HCl+O2$\frac{\underline{\;CuCl_{2}\;}}{450℃}$2Cl2↑+2H2O;氧气和氯化氢;饱和食盐水.
点评 本题考查了氯气的制备及净化,准确把握题干信息找出反应物与生成物是解题关键,注意氯化氢、氯气的性质,题目难度不大.

练习册系列答案
相关题目
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA | |
| B. | 常温常压下,1 L0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| C. | 1 mol有机物 中最多有6 NA个原子在一条直线上 中最多有6 NA个原子在一条直线上 | |
| D. | 1 mol甲基( 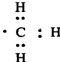 )所含的电子数为7 NA )所含的电子数为7 NA |
4.如表实验不能达到预期实验目的是( )
| 序号 | 实验操作 | 实验目的 |
| A | 在浓硫酸和稀硫酸中分别加入Cu片,加热 | 比较稀、浓硫酸氧化性强弱 |
| B | F2、Cl2分别与H2反应 | 比较氟、氯的非金属性强弱 |
| C | 把CO2通入到水玻璃中 | 比较碳、硅的非金属性强弱 |
| D | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
11.下列事实不能用电化学原理解释的是( )
| A. | 铝片不用特殊方法保护 | |
| B. | 轮船水线下的船体上装一定数量的锌块 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大 | |
| D. | 镀锌铁比较耐用 |
1.下列各组中的性质比较,不正确的是( )
| A. | 水溶性:SO2>Cl2>CO2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:NH3>H2O>HF | D. | 沸点:F2<Cl2<Br2<I2 |
8.下列说法正确的是( )
| A. | 分子式为C7H16,主链上有2个支链的烷烃共有5种同分异构体 | |
| B. | 异丙醇与NaOH醇溶液共热生成化合物的分子式为:C3H6 | |
| C. | 甘氨酸、丙氨酸和苯丙氨酸脱水,最多可生成9种二肽 | |
| D. | 用酸性KMnO4溶液可鉴别2-丁烯和正丁醛 |
1.下列各元素中,一定属于主族元素的是( )
| A. | X元素能形成+7价的含氧酸及其盐 | |
| B. | Y元素原子最外层电子数为2 | |
| C. | Z元素的阴离子与同一周期稀有气体元素的原子电子层结构相同 | |
| D. | R元素的最高价氧化物是酸性氧化物 |