题目内容
19.葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L.某兴趣小组设计实验方案对葡萄酒中SO2进行测定.Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为SO2(g)?SO2(aq)、SO2+H2O?H2SO3、H2SO3?H++HSO3-、HSO3-?H++SO32-.
(2利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3.设计如下实验:
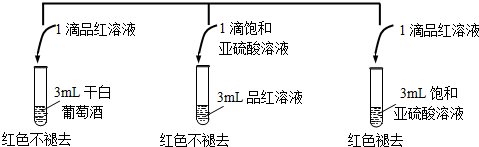
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:干白中二氧化硫或亚硫酸含量太少.
Ⅱ.定量实验方案如下(部分装置和操作略):
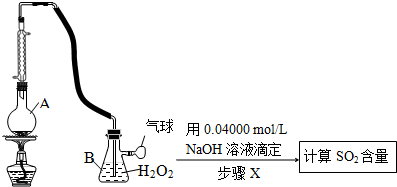
(3)仪器A的名称是圆底烧瓶.
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为SO2+H2O2═H2SO4.
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定,除去H2O2的方法是加入二氧化锰并振荡.
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为0.32 g/L.该测定结果比实际值偏高,分析原因盐酸的挥发造成的干扰.(已知滴定过程中,操作均准确)
分析 (1)二氧化硫与水反应生成亚硫酸,亚硫是二元弱酸,能分步电离;
(2)干白葡萄酒不能使品红溶液褪色的可能原因是干白葡萄酒中二氧化硫或亚硫酸含量太少;
(3)根据装置图可知仪器名称;
(4)二氧化硫与双氧水发生氧化还原反应生成硫酸;
(5)双氧水在二氧化锰作催化剂的条件下发生分解反应生成水和氧气;
(6)二氧化硫被氧化成硫酸,用过量的氢氧化钠中和,剩余的氢氧化钠用盐酸滴定,根据盐酸的物质的量及氢氧化钠的总物质的量可计算出与硫酸反应的氢氧化钠的物质的量,进而得出硫酸的物质的量,根据硫元素守恒计算二氧化硫及酒中的二氧化硫的含量;由于盐酸易挥发,有部分氯化氯会挥发到B装置中,所以会使氢氧化钠的用量偏多,据此分析.
解答 解:(1)二氧化硫与水反应生成亚硫酸,亚硫是二元弱酸,能分步电离,涉及的平衡方程式为SO2(g)?SO2(aq)、SO2+H2O?H2SO3、H2SO3?H++HSO3-、HSO3-?H++SO32-,
故答案为:SO2(g)?SO2(aq)、SO2+H2O?H2SO3、H2SO3?H++HSO3-、HSO3-?H++SO32-;
(2)干白葡萄酒不能使品红溶液褪色的可能原因是干白葡萄酒中二氧化硫或亚硫酸含量太少,
故答案为:干白中二氧化硫或亚硫酸含量太少;
(3)根据装置图可知仪器A名称为圆底烧瓶,
故答案为:圆底烧瓶;
(4)二氧化硫与双氧水发生氧化还原反应生成硫酸,反应的方程式为SO2+H2O2═H2SO4,
故答案为:SO2+H2O2═H2SO4;
(5)双氧水在二氧化锰作催化剂的条件下发生分解反应生成水和氧气,所以除去H2O2的方法是加入二氧化锰并振荡,
故答案为:加入二氧化锰并振荡;
(6)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0400mol/L×0.025L)×64g/mol=0.032g,该葡萄酒中的二氧化硫含量为:$\frac{0.032g}{0.1L}$=0.32g/L,由于盐酸易挥发,有部分氯化氯会挥发到B装置中,所以会使氢氧化钠的用量偏多,所以会导致测定结果比实际值偏高,
故答案为:0.32;盐酸的挥发造成的干扰.
点评 本题考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.

完成下列填空:
(1)R原子的电子排布式是1s22s22p63s23p2;X所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3;Z的氢化物的水溶液可用于雕刻玻璃;Q、R、U的单质形成的晶体,熔点由高到低的排列顺序是Si>Mg>Cl2.
(2)CuSO4能用作T4中毒的解毒剂,反应可生成T的最高价含氧酸和铜,该反应的化学方程式是10CuSO4+P4+16H2O→4H3PO4+10Cu+10H2SO4.
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀.工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含FeO),充分搅拌使之溶解.
(3)除去该溶液中杂质离子的方法是在溶液中通入Cl2,再加入CuO粉末调节pH为4~5.
碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能(KJ/mol) | 356 | 413 | 226 | 318 |
第三周期部分元素氟化物的熔点如下:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| A. | b-3 | B. | b+5 | C. | b+4 | D. | b一11 |
| A. | 金属性:X<Y | |
| B. | 原子半径:Y>Z | |
| C. | 最简单氢化物的热稳定性:Z>W | |
| D. | Y元素氧化物不溶于X元素最高价氧化物对应水化物的水溶液 |
| 序号 | 实验操作 | 实验目的 |
| A | 在浓硫酸和稀硫酸中分别加入Cu片,加热 | 比较稀、浓硫酸氧化性强弱 |
| B | F2、Cl2分别与H2反应 | 比较氟、氯的非金属性强弱 |
| C | 把CO2通入到水玻璃中 | 比较碳、硅的非金属性强弱 |
| D | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 铝片不用特殊方法保护 | |
| B. | 轮船水线下的船体上装一定数量的锌块 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大 | |
| D. | 镀锌铁比较耐用 |
| A. | 分子式为C7H16,主链上有2个支链的烷烃共有5种同分异构体 | |
| B. | 异丙醇与NaOH醇溶液共热生成化合物的分子式为:C3H6 | |
| C. | 甘氨酸、丙氨酸和苯丙氨酸脱水,最多可生成9种二肽 | |
| D. | 用酸性KMnO4溶液可鉴别2-丁烯和正丁醛 |