题目内容
5.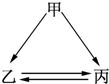 下列各组物质不能一步实现如图转化关系的是( )
下列各组物质不能一步实现如图转化关系的是( )| 物质 组别 | 甲 | 乙 | 丙 |
| A | Na | NaOH | NaCl |
| B | AlO3 | Na AlO2 | Al(OH)3 |
| C | CuO | Cu(OH)2 | CuSO4 |
| D | Fe | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.钠与水反应生成氢氧化钠,钠与盐酸反应生成氯化钠,电解氯化钠溶液生成氢氧化钠,氢氧化钠与氯气反应生成氯化钠;
B.化铝不能与水反应生成氢氧化铝;
C.氧化铜与水不反应;
D.铁与氯气反应生成氯化铁,与盐酸反应生成氯化亚铁,氯气与氯化亚铁生成氯化铁,氯化铁与铁反应生成氯化亚铁.
解答 解:A.钠与水反应生成氢氧化钠,钠与盐酸反应生成氯化钠,电解氯化钠溶液生成氢氧化钠,氢氧化钠与氯气反应生成氯化钠,所以A组物质能一步实现如图转化关系,故A不选;
B.氧化铝不能与水反应生成氢氧化铝,氧化铝到氢氧化铝不能一步实现,故B选;
C.氧化铜与水不反应,不能一步实现氧化铜到氢氧化铜的转化,故C选;
D.铁与氯气反应生成氯化铁,与盐酸反应生成氯化亚铁,氯气与氯化亚铁生成氯化铁,氯化铁与铁反应生成氯化亚铁,所以D组物质能一步实现如图转化关系,故D不选;
故选:BC.
点评 本题考查了元素化合物之间的转化,熟悉相关物质的性质是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
20.下列说法错误的是( )
| A. | 室温下,pH=4的NaHSO4溶液中,水电离出的c(H+)为1×10-10mol•L-1 | |
| B. | 向纯水中加入盐类物质,有可能促进水的电离,也有可能抑制水的电离 | |
| C. | pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液的c(NH${\;}_{4}^{+}$):②<③<① | |
| D. | 用0.1mol•L-1醋酸滴定0.1mol•L-1NaOH溶液至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+) |
13.将一定体积的SO3(g)充入恒容的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值增大的是( )
| A. | 平衡常数 | B. | SO3(g)的转化率 | C. | 总压强 | D. | 总体积 |
20.一定条件下,向一带活塞的密闭容器中充入3mol H2和1mol N 2,发生下列反应:3H2(g)+N2(g)?2NH3(g).达到平衡后改变下述条件,HN3气体平衡浓度不改变的是( )
| A. | 保持温度和容器内压强不变,充入1molNH3(g) | |
| B. | 保持温度和容器内压强不变,充入1molAr(g) | |
| C. | 保持温度和容器体积不变,充入1molN2(g) | |
| D. | 保持温度和容器体积不变,充入1molNH3(g) |
17.常温时,在(NH4)2SO4溶液中滴加Ba(OH)2溶液,下列有关选项正确的是( )
| A. | 滴加前:c(NH4+)+c(H+)=c(OH-)+c(SO42-) | |
| B. | 滴加前:c(NH4+)+c(NH3•H2O)=c(SO42-) | |
| C. | 滴加至完全沉淀:c(OH-)>c(NH4+)>c(H+) | |
| D. | 滴加至中性:c(SO42-)=2c(NH4+)>c(H+)=c(OH-) |


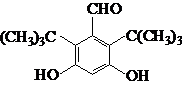
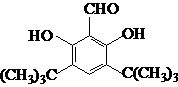
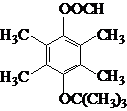 .
.
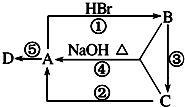 如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:
如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答: