题目内容
15.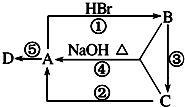 如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:
如图A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋,试回答:(1)写出反应类型:④消去反应,⑤加聚反应.
(2)反应②的条件是浓硫酸,170°;
(3)写出化学方程式:B→CCH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2OH+NaBr.
分析 A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋为聚乙烯,则A为乙烯B为溴乙烷,C为乙醇,反应①是乙烯和HBr的加成反应,②是乙醇的消去反应,③是溴乙烷的水解反应,④溴乙烷的消去反应,⑤乙烯加成聚合反应,据此分析回答问题.
解答 解:A、B、C是中学化学中最常见的三种有机化合物,D是高分子化合物,常用来制造食品和药品包装袋为聚乙烯,则A为乙烯B为溴乙烷,C为乙醇,反应①是乙烯和HBr的加成反应,②是乙醇的消去反应,③是溴乙烷的水解反应,④溴乙烷的消去反应,⑤乙烯加成聚合反应,(12分)
(1)上述分析可知反应④是溴乙烷在氢氧化钠的醇溶液中发生的消去反应生成乙烯、溴化钠和水,反应⑤是乙烯在引发条件下发生的加成聚合反应,生成聚乙烯,
故答案为:消去反应,加聚反应;
(2)反应②是乙醇的消去反应,是乙醇在浓硫酸做催化剂的作用下迅速加热至170°生成乙烯和水,
故答案为:浓硫酸,170°;
(3)B-C的反应是溴乙烷在氢氧化钠溶液中加热发生水解反应生成乙醇和溴化钠,反应的化学方程式为:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2OH+NaBr,
故答案为:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2OH+NaBr.
点评 本题考查了有机物性质和转化的分析判断,常用来制造食品和药品包装袋为聚乙烯是解题的突破口,掌握乙烯制备方法是解题关键,注意反应条件的分析应用,题目难度中等.

练习册系列答案
相关题目
5. 下列各组物质不能一步实现如图转化关系的是( )
下列各组物质不能一步实现如图转化关系的是( )
 下列各组物质不能一步实现如图转化关系的是( )
下列各组物质不能一步实现如图转化关系的是( )| 物质 组别 | 甲 | 乙 | 丙 |
| A | Na | NaOH | NaCl |
| B | AlO3 | Na AlO2 | Al(OH)3 |
| C | CuO | Cu(OH)2 | CuSO4 |
| D | Fe | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
6.下列图示与对应的叙述相符的是( )
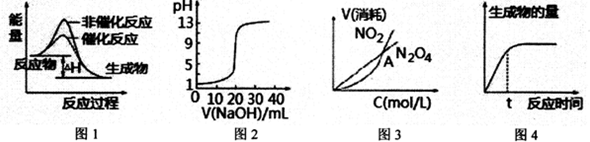

| A. | 图l表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1 000mol•L-1 CH3COOH溶液所得到的滴定曲线 | |
| C. | 图3表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. | 图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正>v逆 |
20.根据如图,判断下列说法中错误的是( )
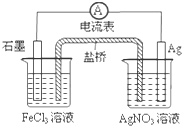

| A. | 导线上电子由Ag极流向石墨极 | B. | 负极电极反应式:Fe3++e-═Fe2+ | ||
| C. | 盐桥中阴离子移向AgNO3溶液 | D. | 总反应为:Fe3++Ag═Fe2++Ag+ |
4.下列状态的物质,既能导电又属于电解质的是( )
| A. | 熔融的KOH | B. | NaCl溶液 | C. | 液态HCl | D. | MgCl2晶体 |
5.化学知识在生产和生活中有着重要的应用.下列说法中,错误的是( )
| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 明矾常作为净水剂,双氧水通常可用于作杀菌消毒 | |
| C. | 金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| D. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 |
 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: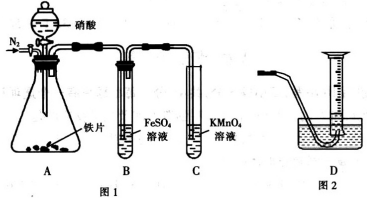 为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.
为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验.