题目内容
20.下列说法错误的是( )| A. | 室温下,pH=4的NaHSO4溶液中,水电离出的c(H+)为1×10-10mol•L-1 | |
| B. | 向纯水中加入盐类物质,有可能促进水的电离,也有可能抑制水的电离 | |
| C. | pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液的c(NH${\;}_{4}^{+}$):②<③<① | |
| D. | 用0.1mol•L-1醋酸滴定0.1mol•L-1NaOH溶液至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+) |
分析 A.室温下,硫酸氢钠是强酸强碱酸式盐,相当于强酸溶液,抑制水电离,水电离出的c(H+)=c(OH-);
B.酸或碱抑制水电离,含有弱离子的盐促进水电离;
C.氯化铵和硫酸铵中铵根离子水解程度相同,铝离子抑制铵根离子水解;
D.混合溶液呈中性时c(H+)=c(OH-),结合电荷守恒得c(CH3COO-)=c(Na+).
解答 解:A.室温下,硫酸氢钠是强酸强碱酸式盐,相当于强酸溶液,抑制水电离,水电离出的c(H+)=c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=1×10-10mol•L-1,故A正确;
B.酸电离出氢离子、碱电离出氢氧根离子,所以酸或碱抑制水电离,含有弱离子的盐能和水电离出的氢离子或氢氧根离子反应生成弱电解质,所以能促进水电离,故B正确;
C.氯化铵和硫酸铵中铵根离子水解程度相同,要使①③溶液的pH相同,则铵根离子浓度①=③,故C错误;
D.混合溶液呈中性时c(H+)=c(OH-),结合电荷守恒得c(CH3COO-)=c(Na+),所以c(CH3COO-)+c(CH3COOH)>c(Na+),故D正确;
故选C.
点评 本题考查离子浓度大小比较、水电离影响因素等知识点,为高频考点,明确溶液中溶质及其性质、水的电离影响因素、溶液中水电离出氢离子浓度计算方法是解本题关键,易错选项是C.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.将足量的CO2通入下列溶液中,能产生沉淀的是( )
| A. | 硅酸钠溶液 | B. | 石灰水 | C. | 次氯酸钠溶液 | D. | 氯化钙溶液 |
11.下列实验操作或所记录的数据合理的是( )
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 配制500ml 0.1mol/L的NaOH溶液时,应用托盘天平称取2.00g NaOH固体 | |
| D. | 氢氟酸可保存在棕色玻璃瓶中 |
8.下列试剂保存正确的是( )
| A. | 氯水保存在棕色细口瓶中 | B. | NaOH保存在具有玻璃塞的细口瓶中 | ||
| C. | 金属钠保存在CCl4中 | D. | 氢氟酸保存在玻璃塞的细口瓶中 |
15.下列说法正确的是( )
| A. | 某溶液中滴加硝酸酸化的Ba(NO3)2溶液有白色沉淀,该溶液一定有SO42- | |
| B. | 某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清的石灰水中产生白色沉淀,则该溶液一定有CO32- | |
| C. | 某溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有NH4+ | |
| D. | 某溶液中滴加AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl- |
5.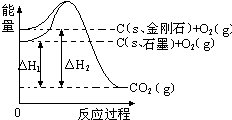 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )| A. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 石墨和金刚石是同分异构体 |
12.下列各组离子,在水溶液中能大量共存的是( )
| A. | Na+、Ag+、Cl- | B. | Ba2+、H+、CO32- | C. | K+、Al3+、OH- | D. | Na+、Cl-、NO3- |
9.CoCl2•6H2O是一种饲料营养强化剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
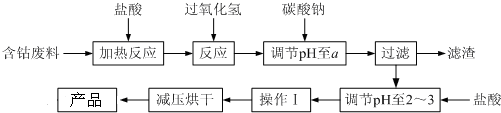
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少氮氧化合物等有毒气体的排放,防止产品中混有硝酸盐.
(2)加入过氧化氢的作用是将Fe2+氧化成Fe3+.
(3)加入碳酸钠调节pH至a,a的范围是5.2~7.6.
(4)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是样品中含有NaCl杂质(或烘干时失去了部分结晶水).

已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少氮氧化合物等有毒气体的排放,防止产品中混有硝酸盐.
(2)加入过氧化氢的作用是将Fe2+氧化成Fe3+.
(3)加入碳酸钠调节pH至a,a的范围是5.2~7.6.
(4)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是样品中含有NaCl杂质(或烘干时失去了部分结晶水).
5.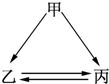 下列各组物质不能一步实现如图转化关系的是( )
下列各组物质不能一步实现如图转化关系的是( )
 下列各组物质不能一步实现如图转化关系的是( )
下列各组物质不能一步实现如图转化关系的是( )| 物质 组别 | 甲 | 乙 | 丙 |
| A | Na | NaOH | NaCl |
| B | AlO3 | Na AlO2 | Al(OH)3 |
| C | CuO | Cu(OH)2 | CuSO4 |
| D | Fe | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |