题目内容
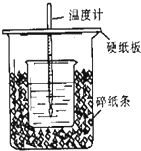 用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)烧杯间填满碎纸条的作用是
(2)从实验装置上看,图中尚缺少的一种玻璃用品是
(3)实验时氢氧化钠溶液的浓度要用0.55mol/L的原因
(4)此实验装置还有一处错误的是
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会
(6)双鸭山一中某化学小组利用改良后的此装置测量了醋酸的中和热(文献值53.5KJ?mol-1),在小烧杯(另选)中改加入100mL0.50mol?L-1的CH3COOH溶液与100mL0.55mol?L-1的NaOH溶液,温度从298.0K升高至300.5K.假设实验装置的热容常数(各部件每升高1K所需要的热量)是160J?K-1,溶液密度均为1g?mL,生成溶液的比热容c=4.2J?(g?K)-1.试求CH3COOH中和热的△H=KJ?mol-1,实验值与理论值不一致的原因是
考点:中和热的测定
专题:实验设计题,化学反应中的能量变化
分析:(1)中和热测定实验成败的关键是保温工作,根据量热计的构造来判断该装置的烧杯间填满碎纸条的作用;
(2)根据量热计的构造来判断该装置的缺少仪器;
(3)根据氢氧化钠过量能保证盐酸完全反应;反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)小烧杯和硬纸板之间空隙太大,也会导致热量损失;
(5)根据弱电解质电离吸热分析.
(6)先根据溶液反应放出的热量Q=-cm△T+160J?0C-1×△T,再根据中和热△H=
计算即可;
根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低.
(2)根据量热计的构造来判断该装置的缺少仪器;
(3)根据氢氧化钠过量能保证盐酸完全反应;反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)小烧杯和硬纸板之间空隙太大,也会导致热量损失;
(5)根据弱电解质电离吸热分析.
(6)先根据溶液反应放出的热量Q=-cm△T+160J?0C-1×△T,再根据中和热△H=
| -Q |
| n(H2O) |
根据实验的关键是保温,如果装置有能量散失,则会导致结果偏低.
解答:
解:(1)根据量热计的构造和实验的成败关键来判断该装置的大小烧杯间填满碎纸条的作用是保温、隔热,防止热量散失,
故答案为:保温、隔热,防止热量散失;
(2)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,
故答案为:环形玻璃搅拌棒;
(3)用过量的氢氧化钠保证盐酸反应完全,以盐酸的量为准进行准确计算,
反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL 0.5mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
故答案为:要保证盐酸反应完全;相等;不相等;
(4)小烧杯和硬纸板之间空隙太大,也会导致热量损失;
故答案为:小烧杯和硬纸板之间空隙太大;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,
故答案为:偏小.
(6)温度差△t=300.5K-298.0K=2.5K,Q=2.5K×4.2J?(g?K)-1×200g+160J?K-1×2.5K=2500J=2.5kJ,△H=
=-
=-50 kJ/mol,
测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小;
把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小;
大烧杯的盖板中间小孔太大,会导致一部分能量散失,所以测的数值降低等;
故答案为:-50 kJ/mol,试验过程中装置有能量散失,则导致结果偏低.
故答案为:保温、隔热,防止热量散失;
(2)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,
故答案为:环形玻璃搅拌棒;
(3)用过量的氢氧化钠保证盐酸反应完全,以盐酸的量为准进行准确计算,
反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL 0.5mol?L-1的盐酸与50mL 0.55mol?L-1的氢氧化钠溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
故答案为:要保证盐酸反应完全;相等;不相等;
(4)小烧杯和硬纸板之间空隙太大,也会导致热量损失;
故答案为:小烧杯和硬纸板之间空隙太大;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,
故答案为:偏小.
(6)温度差△t=300.5K-298.0K=2.5K,Q=2.5K×4.2J?(g?K)-1×200g+160J?K-1×2.5K=2500J=2.5kJ,△H=
| -Q |
| n(H2O) |
| 2.5kJ |
| 0.05mol |
测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小;
把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓,会导致一部分能量的散失,实验测得中和热的数值偏小;
大烧杯的盖板中间小孔太大,会导致一部分能量散失,所以测的数值降低等;
故答案为:-50 kJ/mol,试验过程中装置有能量散失,则导致结果偏低.
点评:本题考查学生中和热测定,保温工作是实验成功的关键,掌握实验原理即可解答,难度不大.

练习册系列答案
相关题目
下列离子方程式与所述事实相符且正确的是( )
| A、用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-═I2+2OH- |
| B、高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O |
| C、AlCl3溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
能正确表示下列反应的离子方程式为( )
| A、碘化亚铁溶于稀硝酸中:3Fe2++4H++NO3-=3Fe3++NO↑+2 H2O | ||||
| B、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | ||||
C、向沸水中滴入几滴饱和氯化铁溶液,并加热至溶液成红褐色:Fe3++3H2O
| ||||
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
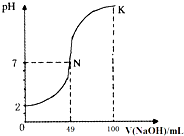 常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )| A、H2A为二元强酸 |
| B、K点时加水稀释溶液,c(H+)增大 |
| C、N点对应溶液有:c(Na+)=c(A2-)+c(HA-) |
| D、K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+) |
在稀醋酸溶液中,欲使醋酸电离平衡右移且氢离子浓度增大,应采取的措施是( )
| A、加入NaOH | B、加入盐酸 |
| C、加水 | D、升高温度 |
 已知醋酸是日常生活中常见的弱酸.
已知醋酸是日常生活中常见的弱酸.