题目内容
A、B、C、D、E、F为短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素;D的+1价阳离子与氖原子具有相同的电子层结构;C和E同主族,C和E的原子序数之和是A和D的原子序数之和的2倍;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸.请根据以上信息回答下列问题.
(1)F元素在元素周期表中的位置是 .
(2)B的氢化物的水溶液呈碱性,用离子方程式表示原因: .
(3)A2C2可以制备C2,该反应的化学方程式是 .
(4)A、B、C 3种元素形成的既含离子键又含共价键的化合物的化学式是 .
(5)E的单质和E的最高价含氧酸的浓溶液加热发生反应,该反应的化学方程式是 .
(1)F元素在元素周期表中的位置是
(2)B的氢化物的水溶液呈碱性,用离子方程式表示原因:
(3)A2C2可以制备C2,该反应的化学方程式是
(4)A、B、C 3种元素形成的既含离子键又含共价键的化合物的化学式是
(5)E的单质和E的最高价含氧酸的浓溶液加热发生反应,该反应的化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F为短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素,则A为氢元素;D的+1价阳离子与氖原子具有相同的电子层结构,则D为钠元素;C和E同主族,C和E的原子序数之和是A和D的原子序数之和的2倍,则C为氧元素,E为硫元素,F是原子序数大于E的短周期元素,所以F为氯元素;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸,则B为氮元素,据此答题.
解答:
解:A、B、C、D、E、F为短周期主族元素,原子序数依次增大,A是相对原子质量最小的元素,则A为氢元素;D的+1价阳离子与氖原子具有相同的电子层结构,则D为钠元素;C和E同主族,C和E的原子序数之和是A和D的原子序数之和的2倍,则C为氧元素,E为硫元素,F是原子序数大于E的短周期元素,所以F为氯元素;B和C为同周期元素,B的最高价氧化物对应的水化物是一种强酸,则B为氮元素,
(1)F为氯元素,位于周期表中第三周期第ⅤⅡA族,故答案为:第三周期第ⅤⅡA族;
(2)B的氢化物为氨气,它与水结合成一水合氨,能电离出氢氧根离子,所以它的水溶液呈碱性,用离子方程式表示为NH3?H2O?NH4++OH-,故答案为:NH3?H2O?NH4++OH-;
(3)A2C2为H2O2,在二氧化锰做催化剂的条件下可以制备O2,反应的化学方程式为2H2O2
2H2O+O2↑,故答案为:2H2O2
2H2O+O2↑;
(4)A、B、C分别为H、N、O,3种元素形成的既含离子键又含共价键的化合物为硝酸铵,它的化学式是NH4NO3,故答案为:NH4NO3;
(5)E为硫元素,单质硫和硫酸的浓溶液加热发生氧化还反应,该反应的化学方程式是S+2H2SO4(浓)
3SO2↑+2H2O,故答案为:S+2H2SO4(浓)
3SO2↑+2H2O.
(1)F为氯元素,位于周期表中第三周期第ⅤⅡA族,故答案为:第三周期第ⅤⅡA族;
(2)B的氢化物为氨气,它与水结合成一水合氨,能电离出氢氧根离子,所以它的水溶液呈碱性,用离子方程式表示为NH3?H2O?NH4++OH-,故答案为:NH3?H2O?NH4++OH-;
(3)A2C2为H2O2,在二氧化锰做催化剂的条件下可以制备O2,反应的化学方程式为2H2O2
| ||
| ||
(4)A、B、C分别为H、N、O,3种元素形成的既含离子键又含共价键的化合物为硝酸铵,它的化学式是NH4NO3,故答案为:NH4NO3;
(5)E为硫元素,单质硫和硫酸的浓溶液加热发生氧化还反应,该反应的化学方程式是S+2H2SO4(浓)
| ||
| ||
点评:本题主要考查了元素周期表及部分元素化合物知识,难度不大,解题时注意根据原子结构特点,确定元素种类.

练习册系列答案
相关题目
离子方程式H++OH-=H2O所表示的反应是( )
| A、所有酸和碱之间的中和反应 |
| B、强酸溶液与强碱溶液生成可溶性盐和水的反应 |
| C、所有可溶性酸和可溶性碱之间的中和反应 |
| D、所有强酸和强碱之间的中和反应 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
B、在
| ||
| C、在0.1 mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
| D、在0.1 mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- |

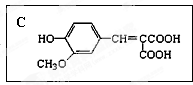

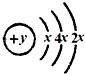 ;F的最外层电子数是电子层数的2倍.
;F的最外层电子数是电子层数的2倍.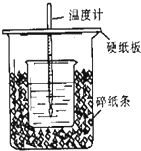 用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题: