题目内容
某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3?6H2O晶体.(图中夹持及尾气处理装置均已略去)
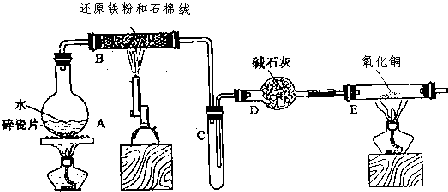
(1)装置B中发生反应的化学方程式是 .
(2)装置E中的现象是 .
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.
简述检验滤液中Fe3+的操作方法 .
(4)该小组学生利用上述滤液制取FeCl3?6H2O晶体,设计流程如下:
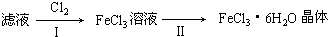
①步骤I中通入Cl2的作用是 .
②步骤II从FeCl3稀溶液中得到FeCl3?6H2O晶体的主要操作包括: .
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明) .

(1)装置B中发生反应的化学方程式是
(2)装置E中的现象是
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.
简述检验滤液中Fe3+的操作方法
(4)该小组学生利用上述滤液制取FeCl3?6H2O晶体,设计流程如下:
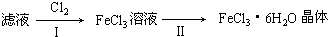
①步骤I中通入Cl2的作用是
②步骤II从FeCl3稀溶液中得到FeCl3?6H2O晶体的主要操作包括:
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
考点:性质实验方案的设计,制备实验方案的设计
专题:实验设计题
分析:(1)铁与水蒸气高温下反应生成四氧化三铁和氢气,据此写出反应的化学方程式;
(2)装置E中红色的氧化铁被氢气还原成黑色的铁,同时有水珠生成;
(3)根据三价铁的检验方法加KSCN溶液,观察是否变红;
(4)①根据流程结合氯气的强氧化性分析氯气的作用;
②由FeCl3稀溶液中得到FeCl3?6H2O晶体需加热浓缩、冷却晶体,过滤;
③由于铁离子易水解,应在酸溶液中加热浓缩,主要是抑制三价铁的水解.
(2)装置E中红色的氧化铁被氢气还原成黑色的铁,同时有水珠生成;
(3)根据三价铁的检验方法加KSCN溶液,观察是否变红;
(4)①根据流程结合氯气的强氧化性分析氯气的作用;
②由FeCl3稀溶液中得到FeCl3?6H2O晶体需加热浓缩、冷却晶体,过滤;
③由于铁离子易水解,应在酸溶液中加热浓缩,主要是抑制三价铁的水解.
解答:
解:(1)装置B中铁粉与水蒸气在高温下发生反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O
Fe3O4+H2,
故答案为:3Fe+4H2O
Fe3O4+H2;
(2)装置B铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铜与氢气加热发生反应生成了铜和水,所以反应的现象为:黑色的粉末变成紫红色,管壁产生水珠,故答案为:黑色的粉末变成紫红色,管壁产生水珠;
(3)检验三价铁用KSCN溶液,观察是否变红,故答案为:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色;
(4)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,故答案为:将Fe2+氧化成Fe3+;
②由FeCl3稀溶液中得到FeCl3?6H2O晶体需加热浓缩、冷却结晶、过滤,故答案为:加热浓缩、冷却结晶、过滤;
③由于铁离子易水解,水解方程式为:Fe3++3H2O Fe(OH)3+3H+,所以应在酸溶液中加热浓缩,主要是抑制三价铁的水解,故保持盐酸过量,
Fe(OH)3+3H+,所以应在酸溶液中加热浓缩,主要是抑制三价铁的水解,故保持盐酸过量,
故答案为:Fe3++3H2O Fe(OH)3+3H+,过量盐酸抑制FeCl3水解.
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解.
| ||
故答案为:3Fe+4H2O
| ||
(2)装置B铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铜与氢气加热发生反应生成了铜和水,所以反应的现象为:黑色的粉末变成紫红色,管壁产生水珠,故答案为:黑色的粉末变成紫红色,管壁产生水珠;
(3)检验三价铁用KSCN溶液,观察是否变红,故答案为:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色;
(4)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,故答案为:将Fe2+氧化成Fe3+;
②由FeCl3稀溶液中得到FeCl3?6H2O晶体需加热浓缩、冷却结晶、过滤,故答案为:加热浓缩、冷却结晶、过滤;
③由于铁离子易水解,水解方程式为:Fe3++3H2O
 Fe(OH)3+3H+,所以应在酸溶液中加热浓缩,主要是抑制三价铁的水解,故保持盐酸过量,
Fe(OH)3+3H+,所以应在酸溶液中加热浓缩,主要是抑制三价铁的水解,故保持盐酸过量,故答案为:Fe3++3H2O
 Fe(OH)3+3H+,过量盐酸抑制FeCl3水解.
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解.
点评:本题考查了铁及其化合物的性质实验,题目难度不大,注意掌握铁与水蒸气反应原理,试题侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

练习册系列答案
相关题目
下列各组物质均属于硅酸盐制品的是( )
| A、陶瓷、水泥 |
| B、单晶硅、玻璃 |
| C、石膏、漂白粉 |
| D、水玻璃、铝热剂 |
某气体由常见的一种或多种气体组成,经测定其中只含有碳、氧两种元素,碳、氧元素的质量比为3:8,则关于该气体的说法正确的是( )
| A、该气体一定是纯净物 |
| B、该气体一定是CO、CO2的混合物 |
| C、该气体中所含的物质最多只有2种 |
| D、该气体的组成情况可能有3种组合 |
25℃时,已知弱酸的电离常数:K(CH3COOH)=1.8×10-5;K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8.则下列说法正确的是( )
| A、新制氯水与碳酸氢钠不反应 |
| B、25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者 |
| C、25℃时,等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pHpH(Na2CO3)>pH(NaClO)>pH(CH3COONa) |
| D、25℃时,PH=9的NaHCO3溶液中:C(HCO3-)>C(CO32-)>C(H2CO3) |
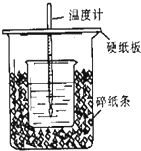 用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 利用如图所示装置制备氧气并进行相关实验探究.
利用如图所示装置制备氧气并进行相关实验探究.

 已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:
已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题: