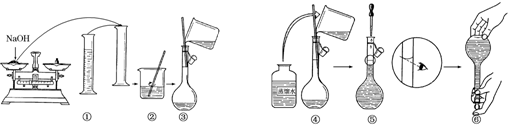
题目内容
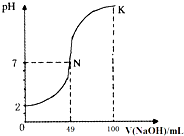 常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )
常温下,向100mL0.1mol?L-1H2A(二元酸)溶液中逐滴加入0.2mol?L-1NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列有关说法正确的是( )| A、H2A为二元强酸 |
| B、K点时加水稀释溶液,c(H+)增大 |
| C、N点对应溶液有:c(Na+)=c(A2-)+c(HA-) |
| D、K点对应溶液中离子浓度由大到小的顺序为:c(A2-)>c(Na+)>c(OH-)>c(H+) |
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:A、图象分析向100mL 0.1mol?L-1 H2A(二元酸)溶液PH=2,说明H2A为弱酸;
B、K点对应溶液中向100mL 0.1mol?L-1 H2A(二元酸)溶液中逐滴加入0.2mol?L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大;
C、依据溶液中电荷守恒分析判断离子浓度大小;
D、K点对应溶液中向100mL 0.1mol?L-1 H2A(二元酸)溶液中逐滴加入0.2mol?L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小比较.
B、K点对应溶液中向100mL 0.1mol?L-1 H2A(二元酸)溶液中逐滴加入0.2mol?L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大;
C、依据溶液中电荷守恒分析判断离子浓度大小;
D、K点对应溶液中向100mL 0.1mol?L-1 H2A(二元酸)溶液中逐滴加入0.2mol?L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小比较.
解答:
解:A、图象分析,100mL 0.1mol?L-1 H2A(二元酸)溶液PH=2,说明氢离子未全部电离,H2A为弱酸,故A错误;
B、K点对应溶液中向100mL 0.1mol?L-1 H2A(二元酸)溶液中逐滴加入0.2mol?L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大,c(H+)增大,故B正确;
C、依据溶液中电荷,c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),如呈中性,c(H+)=c(OH-),c(Na+)=2c(A2-)+c(HA-),故C错误;
D、K点对应溶液中向100mL 0.1mol?L-1 H2A(二元酸)溶液中逐滴加入0.2mol?L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小为:c(Na+)>c(A2-)>c(OH-)>c(H+),故D错误;
故选B.
B、K点对应溶液中向100mL 0.1mol?L-1 H2A(二元酸)溶液中逐滴加入0.2mol?L-1 NaOH溶液100ml,恰好反应生成Na2A,加水促进水解,溶液中氢氧根离子浓度减小,结合离子积常数分析氢离子浓度增大,c(H+)增大,故B正确;
C、依据溶液中电荷,c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),如呈中性,c(H+)=c(OH-),c(Na+)=2c(A2-)+c(HA-),故C错误;
D、K点对应溶液中向100mL 0.1mol?L-1 H2A(二元酸)溶液中逐滴加入0.2mol?L-1 NaOH溶液100ml,恰好反应生成Na2A,依据溶液中离子浓度大小为:c(Na+)>c(A2-)>c(OH-)>c(H+),故D错误;
故选B.
点评:本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,图象分析是关键,题目难度中等.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、在pH=1的溶液中:K+、Na+、SO42-、HCO3- | ||
B、在
| ||
| C、在0.1 mol?L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | ||
| D、在0.1 mol?L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- |
下列有关水资源保护的说法中,不正确的是( )
| A、重金属离子对人体有毒,常采用沉淀反应将之除去 |
| B、化肥中含有植物营养素,可大量使用以改善水环境 |
| C、轧钢厂排出的含盐酸的废水,可用熟石灰中和处理 |
| D、天然水中的细小悬浮颗粒,可用明矾等混凝剂净化 |
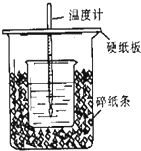 用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.5mol/L的盐酸与50mL0.55mol/L的氢氧化钠在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 利用如图所示装置制备氧气并进行相关实验探究.
利用如图所示装置制备氧气并进行相关实验探究.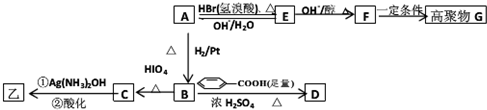


 已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:
已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题: