题目内容
19.下列各组混合物中,能用分液漏斗进行分离的是( )| A. | 酒精和水 | B. | 水和四氯化碳 | C. | 汽油和植物油 | D. | 四氯化碳和苯 |
分析 能用分液漏斗进行分离的物质应互不相溶,结合常见物质的水溶性解答该题.
解答 解:酒精和水、汽油和植物油、四氯化碳和苯都混溶,溶液不分层,而水和四氯化碳分层,可用分液的方法分离,
故选B.
点评 本题考查有机物的水溶性,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意常见有机物的性质,特别是水溶性的特点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.亚氨基锂(Li2NH)是一种储氢容量高,安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2=LiNH2+LiH.下列有关说法正确的是( )
| A. | Li2NH中N的化合价是-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | 每有1molLi2NH参加反应,则有2mol电子转移 | |
| D. | 该反应中H2既是氧化剂,又是还原剂 |
10.除去溶解在苯中的少量苯酚,正确的方法是( )
| A. | 过滤 | B. | 用分液漏斗分液 | ||
| C. | 通入足量CO2后,过滤 | D. | 加入适量NaOH溶液,反应后再分液 |
7.设NA为阿佛加德罗常数,下列说法正确的是( )
| A. | 23g钠在氧气中完全燃烧失去电子数为0.5NA | |
| B. | 1L 2 mol•L-1的AlCl3溶液中含Al3+数为2NA | |
| C. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| D. | 室温下,8g甲烷含有共价键数为2NA |
14.乙酸香兰酯是用于调配奶油、冰淇淋的食用香精,其合成反应的化学方程式如图:下列有关叙述正确的是( )
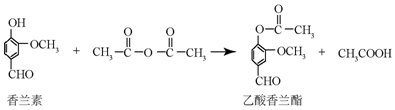

| A. | 乙酸香兰酯的分子式为C18H8O4 | |
| B. | FeCl3溶液可用于区别香兰素与乙酸香兰酯 | |
| C. | 1mol乙酸香兰酯最多可以与5molH2发生加成反应 | |
| D. | 乙酸香兰脂在足量NaOH溶液中水解得到乙酸和香兰素 |
4.下列为周期表的一部分,据此回答下列有关问题:
(1)写出元素符号:①N,⑤Mg,⑦Si,⑧S.
(2)表中所列元素中,最活泼的金属元素是Na(填元素符号,下同),最活泼的非金属元素是F.
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式,下同),碱性最强的是NaOH,呈两性的是Al(OH)3.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)表中所列元素中,最活泼的金属元素是Na(填元素符号,下同),最活泼的非金属元素是F.
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4(填化学式,下同),碱性最强的是NaOH,呈两性的是Al(OH)3.
11.位于周期表第ⅦA族的元素是( )
| A. | H | B. | Mg | C. | O | D. | F |
8.下列解释实验事实的离子方程式正确的是( )
| A. | 用石灰石与稀盐酸制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应生成白色沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水反应后的溶液显碱性:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 二氧化硅与氢氧化钠溶液反应生成硅酸钠:SiO2+2OH-═SiO32-+H2O |
9.下列与化学概念有关的说法正确的是( )
| A. | 化合反应均为氧化还原反应 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| D. | 摩尔是七个基本物理量之一 |