题目内容
3. 氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:(1)磷酸是三元中强酸,其第一级的电离方程式为H3PO4?H2PO4-+H+.
(2)将磷酸加强热时可发生分子间的脱水生成焦磷酸(H4P2O7)、三聚磷酸(H5P3O10)以至直链多聚磷酸.当直链多聚磷酸分子中P原子数为20时,其化学式是H22P20O61.直链多聚磷酸常用于制取阻燃剂.
(3)PH3是一种性能良好的熏蒸剂,用于除治储藏物害虫.
①与同主族元素的氢化物NH3相比,沸点:PH3 <NH3(填“<”或“>”或“=”);稳定性:PH3 <NH3(填“<”、“>”或“=”); 实验室制取PH3可选用PH4I与碱(填物质类别)反应得到.
②PH3气体发生器中常用磷化铝水解,其化学反应方程式是AlP+3H2O=Al(OH)3↓+PH3↑.
(4)利用葡萄糖与银氨溶液反应在热水瓶胆内壁镀银.查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq),该反应平衡常数K稳[Ag(NH3)2+]=1.10×107,又已知Ksp[AgCl]=1.45×10-20.计算可逆反应AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=1.6×10-3(保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl0.04mol(保留2位有效数字).
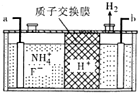
(5)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.a电极为电解池的阳(填“阴”或“阳”)极,其电极反应式为NH4++3F--6e-=NF3+4H+;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是F2.
分析 (1)磷酸属于弱电解质,第一步电离为主;
(2)两分子的磷酸脱去一分子的水,三分子磷酸脱去两分子的水,据此分析;
(3)①同主族元素的氢化物NH3相比,NH3分子之间形成氢键,沸点高.氮元素非金属性强,NH3稳定性强,实验室制取PH3可选用PH4I与碱反应;
②铝盐极易水解;
(4)Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)与AgCl(s)?Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq),故该反应平衡时为前两者平衡常数之积;
计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,结合平衡常数计算解答;
(5)由图可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,据此解答即可.
解答 解:(1)磷酸属于弱电解质,第一步电离为主,磷酸主要的电离方程式:H3PO4?H2PO4-+H+,
故答案为:H3PO4?H2PO4-+H+;
(2)两分子的磷酸脱去一分子的水,三分子磷酸脱去两分子的水,当高聚磷酸中P原子数为20时,为20个磷酸分子间脱去19个水分子,则高聚磷酸的分子式为:H22P20O61;
故答案为:H22P20O61;
(3)①NH3分子之间可形成氢键,故沸点高;氮元素非金属性强,故NH3稳定性强,实验室制取PH3,与制NH3相似,故实验室制取PH3可选用PH4I与碱反应,
故答案为:<;<;碱;
②磷化铝水解的方程式:AlP+3H2O=Al(OH)3↓+PH3↑,
故答案为:AlP+3H2O=Al(OH)3↓+PH3↑;
(4)Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)与AgCl(s)?Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq),平衡常数表达式K=$\frac{c([Ag(N{H}_{3})_{2}]^{+})•c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$=$\frac{c([Ag(N{H}_{3})_{2}]^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$×c(Ag+)×c(Cl-)=1.10×107×1.45×10-10=1.6×10-3,
计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,故$\frac{{x}^{2}}{(1-2x)^{2}}$
=1.6×10-3,解得x=0.04,
故答案为:1.6×10-3;0.04;
(5)由图可知,氢离子在b极得到电子生成氢气,故b为阴极,那么a为阳极,阳极上铵根失去电子生成NF3,电极反应方程式为:NH4++3F--6e-=NF3+4H+,依据电解原理可知,氟离子也可能失去电子生成氟单质,故氧化性较强的单质为氟气,
故答案为:阳;NH4++3F--6e-=NF3+4H+;F2.
点评 本题考查平衡常数有关计算、电离方程式书写,电解池反应原理等,注意结合装置图分析判断电极反应及产物,属于拼合型题目,侧重考查学生分析计算能力、知识迁移运用能力.

| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
 利用所学知识回答下列问题
利用所学知识回答下列问题Ⅰ.(1)已知室温下,Ksp[Mg(OH)2]=5×10-12,若溶液中c(Mg2+)=5×10-4 mol/L,则溶液的pH=10.
(2)向1mL0.1mol/LMgCl2溶液中滴加2滴2mol/LNaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,结果有红褐色沉淀出现.请写出红褐色沉淀生成时的离子方程式3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3.
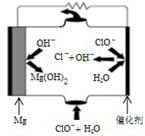
(3)“镁-次氯酸盐”燃料电池的工作原理如图所示,根据图写出镁电极的电极反应式Mg-2e-+2OH-=Mg(OH)2.
Ⅱ.室温下,两种酸的电离平衡常数如下表.
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 1.0×10-7 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(5)0.10mol/L Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02 mol•L-1AgNO3溶液和0.02 mol•L-1 Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL 0.1 mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
| A. | 达到平衡时,c(Pb2+)=c(Fe2+) | |
| B. | Ksp(FeS)大于Ksp(PbS) | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(PbS)}$ | |
| D. | 溶液中加入少量Na2S固体后,c(Fe2+)减小 |
| A. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 | |
| B. | 用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl溶解度大于Ag2CrO4溶解度 | |
| D. | 25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |