题目内容
11.25℃时,已知Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10,Ksp(Ag2C2O4)=3.5×10-11,Ksp(AgI)=1.5×10-16,该温度下有关叙述正确的是( )| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02 mol•L-1AgNO3溶液和0.02 mol•L-1 Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL 0.1 mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
分析 A.根据溶度积常数计算出银离子的浓度,再比较大小;
B.根据Qc与Ksp相对大小判断;
C.溶度积小的沉淀已转化为溶解度更小的沉淀;
D.溶度积小的沉淀先生成.
解答 解:A.在Ag2C2O4饱和溶液中,Ksp(Ag2C2O4)=3.5×10-11 mol3•L-3=$\frac{1}{2}$c3(Ag+),因此c(Ag+)=$\root{3}{7×10{\;}^{-11}}$mol/L,
在AgCl饱和溶液中,Ksp(AgCl)=1.8×10-10 mol2•L-2=c(Ag+)•c(Cl-)=c2(Ag+),因此c(Ag+)=$\sqrt{1.8×10{\;}^{-10}}$mol/L,
在AgI饱和溶液中,Ksp(AgI)=1.5×10-16mol2/L-2=c(Ag+)•c(I-)=c2(Ag+),因此c(Ag+)=$\sqrt{1.5×10{\;}^{-16}}$mol/L;
所以AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI,故A正确;
B.将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,c(Ag+)=0.01mol/L,c(SO42-)=0.01mol/L,则Qc=0.012×0.01=10-6<Ksp(Ag2SO4)=1.2×10-5,所以没有沉淀生成,故B错误;
C.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,溶度积小的沉淀已转化为溶解度更小的沉淀,所以向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,会生成AgI沉淀,故C错误;
D.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,溶度积小的沉淀先生成,所以向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先生成AgI沉淀,故D错误.
故选A.
点评 本题主要考查溶度积常数的概念和有关计算,题目难度中等,做题时注意不同物质的化学式是否相似,化学式相似的溶度积常数越小,溶液的浓度越小,侧重于考查学生的分析能力和计算能力.

| A. | 它的中子数是53 | |
| B. | 摩尔质量是125g | |
| C. | 它与${\;}_{53}^{131}$I 互称同位素 | |
| D. | 其化学性质与${\;}_{53}^{131}$I有很大区别 |
(1)已知:2H2S(g)+3O2(g)=2H2O(l)+2SO2(g)△H=akJ/mol
2SO2(g)+O2(g)═2SO3(g)△H=b kJ/mol
SO3(g)+H2O(l)═H2SO4(l)△H=c kJ/mol
写出由H2S气体一步合成硫酸的热化学方程式H2S(g)+2O2(g)═H2SO4(l)△H=$\frac{a+b+2c}{2}$kJ/mol.
(2)硫化氢气体会污染空气,可用CuSO4溶液除去,写出该离子方程式Cu2++H2S═CuS↓+2H+.除去含Cu2+的废水能(填“能”或“不能”)用FeS作沉淀剂.
[已知Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36)]
(3)t℃,在一密闭容器中发生如下反应 2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H<0,在不同时间测得H2S和SO2的浓度如下表所示:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| c(H2S)/mol/L | 1.00 | 0.80 | 0.62 | 0.48 | 0.40 | 0.40 |
| c(SO2)/mol/L | 1.00 | 0.90 | 0.81 | 0.74 | 0.70 | 0.70 |
②2~8分钟SO2的平均反应速率为0.033mol/(L•min)或$\frac{1}{30}$mol/(L•min).
③t℃时,该反应的平衡常数为8.93(L/mol)3或$\frac{1}{0.112}$(L/mol)3.
| A. | c(Ag+) | B. | $\frac{c(C{l}^{-})}{c(B{r}^{-})}$ | C. | c(Cl-) | D. | $\frac{c(A{g}^{+})•c(B{r}^{-})}{c(C{l}^{-})}$ |
| A. | PH=10的Mg(OH)2浊液C(Mg2+)=10-8 mol•L-1 (已知Mg(OH)2KSP=1×10-16) | |
| B. | 已知AgClKSP=1.8×10-10;Ag2CrO4KSP=1.2×10-12则AgCl的溶解度一定比Ag2CrO4大 | |
| C. | 在饱和AgCl溶液中加入NaI固体不会发生变化 | |
| D. | Fe3+在酸性溶液中一定不会生成Fe(OH)3沉淀 |
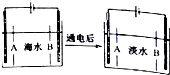 南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:
南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验: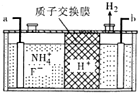 氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题: