题目内容
20.下列反应中,属于氧化还原反应的是( )| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
分析 氧化还原反应的实质为电子转移、特征为化合价升降,所以氧化还原反应中一定存在元素化合价变化,据此对各选项进行判断.
解答 解:A.CaCO3+2HCl═CaCl2+H2O+CO2↑为复分解反应,不存在化合价变化,不属于氧化还原反应,故A错误;
B.2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑为有单质生成的分解反应,Mn、O元素的化合价发生变化,属于氧化还原反应,故B正确;
C.CaO+H2O═Ca(OH)2为化合反应,反应中不存在化合价变化,不属于氧化还原反应,故C错误;
D.CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑为分解反应,反应中不存在化合价变化,不属于氧化还原反应,故D错误;
故选B.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握四种基本反应类型与氧化还原反应之间的关系,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
10.下列各组物质中,分子数相同的是( )
| A. | 5 L Cl2与5 L HCl | |
| B. | 36 g H2O与44.8 L CO2 | |
| C. | 25℃,1.01×105 Pa时,等体积的空气与H2 | |
| D. | 0.2 mol O2与标准状况下2.24 L水 |
8.2008年美国介入放射学科研大会上展示了保罗放射学研究所治疗严重冻伤的医疗成果,可免除冻伤病人截肢.以下关于具有放射性的${\;}_{53}^{125}$I的说法正确的是( )
| A. | 它的中子数是53 | |
| B. | 摩尔质量是125g | |
| C. | 它与${\;}_{53}^{131}$I 互称同位素 | |
| D. | 其化学性质与${\;}_{53}^{131}$I有很大区别 |
15.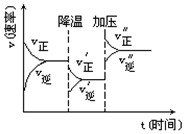 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 降温后逆反应速率增大 | B. | 逆反应是放热反应 | ||
| C. | A、B、C、D均为气体 | D. | 若A、B是气体,则D是液体或固体 |
12.下列关于金属的腐蚀及防腐说法错误的是( )
| A. | 马口铁(镀锡铁)镀层破损铁的腐蚀速率加快 | |
| B. | 为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极 | |
| C. | 可以采用改变金属组成或结构的方法防止金属腐蚀 | |
| D. | 为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块 |
2.硫化氢在工业制硫酸、农药、医药及金属精制等方面有广泛的应用,回答下列问题:
(1)已知:2H2S(g)+3O2(g)=2H2O(l)+2SO2(g)△H=akJ/mol
2SO2(g)+O2(g)═2SO3(g)△H=b kJ/mol
SO3(g)+H2O(l)═H2SO4(l)△H=c kJ/mol
写出由H2S气体一步合成硫酸的热化学方程式H2S(g)+2O2(g)═H2SO4(l)△H=$\frac{a+b+2c}{2}$kJ/mol.
(2)硫化氢气体会污染空气,可用CuSO4溶液除去,写出该离子方程式Cu2++H2S═CuS↓+2H+.除去含Cu2+的废水能(填“能”或“不能”)用FeS作沉淀剂.
[已知Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36)]
(3)t℃,在一密闭容器中发生如下反应 2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H<0,在不同时间测得H2S和SO2的浓度如下表所示:
①增大该反应平衡常数的措施有降低温度.
②2~8分钟SO2的平均反应速率为0.033mol/(L•min)或$\frac{1}{30}$mol/(L•min).
③t℃时,该反应的平衡常数为8.93(L/mol)3或$\frac{1}{0.112}$(L/mol)3.
(1)已知:2H2S(g)+3O2(g)=2H2O(l)+2SO2(g)△H=akJ/mol
2SO2(g)+O2(g)═2SO3(g)△H=b kJ/mol
SO3(g)+H2O(l)═H2SO4(l)△H=c kJ/mol
写出由H2S气体一步合成硫酸的热化学方程式H2S(g)+2O2(g)═H2SO4(l)△H=$\frac{a+b+2c}{2}$kJ/mol.
(2)硫化氢气体会污染空气,可用CuSO4溶液除去,写出该离子方程式Cu2++H2S═CuS↓+2H+.除去含Cu2+的废水能(填“能”或“不能”)用FeS作沉淀剂.
[已知Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36)]
(3)t℃,在一密闭容器中发生如下反应 2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H<0,在不同时间测得H2S和SO2的浓度如下表所示:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| c(H2S)/mol/L | 1.00 | 0.80 | 0.62 | 0.48 | 0.40 | 0.40 |
| c(SO2)/mol/L | 1.00 | 0.90 | 0.81 | 0.74 | 0.70 | 0.70 |
②2~8分钟SO2的平均反应速率为0.033mol/(L•min)或$\frac{1}{30}$mol/(L•min).
③t℃时,该反应的平衡常数为8.93(L/mol)3或$\frac{1}{0.112}$(L/mol)3.
 氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题: