题目内容
19.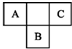 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.(1)写出A、B、C三元素名称氮、硫、氟.
(2)C在元素周期表中的位置是第二周期第ⅤⅡA族.
(3)B的原子结构示意图为
 ,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).
,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).(4)比较A、C的原子半径:A>C.
分析 A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,设A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得:x=7,所以A为N元素、B为S元素、C为F元素,据此结合元素周期律知识解答.
解答 解:(1)A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,设A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,则:x+x+2=x+9,解得:x=7,所以A为N元素、B为S元素、C为F元素,
故答案为:氮;硫;氟;
(2)C是F元素,F原子核外有2个电子层、最外层电子数是7,所以F元素位于第二周期第ⅤⅡA族,
故答案为:第二周期第ⅤⅡA族;
(3)B是S元素,其原子核外有3个电子层、最外层电子数是6,S的原子结构示意图为: ,由于F的非金属性比S强,故HF的稳定性比H2S强,
,由于F的非金属性比S强,故HF的稳定性比H2S强,
故答案为: ;HF;H2S;
;HF;H2S;
(4)同一周期中,原子序数越小,原子半径越大,故N原子半径大于F原子半径,
故答案为:>.
点评 本题考查了位置、结构与性质的关系及应用,题目难度不大,明确原子结构与元素周期表的关系为解答关键,注意掌握元素周期表结构、元素周期律内容,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.28%的KOH溶液中,平均溶有一个OH-所需的水分子的个数为( )
| A. | 6个 | B. | 8个 | C. | 10个 | D. | 28个 |
7.下列反应中,水作氧化剂的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CuO+H2 $\frac{\underline{\;高温\;}}{\;}$ Cu+H2O | D. | Na2O+H2O═2NaOH |
11.下列说法正确的是(NA为阿伏伽德罗常数)( )
| A. | 12g石墨中含有C-C键的个数为1.5NA | |
| B. | 60g SiO2中含有Si-O键的个数为2NA | |
| C. | 18g冰中最多含有4 NA个氢键 | |
| D. | 标准状况下,11.2 L CHCl3中含有的分子数为0.5NA |
8.世界上一次性建成的最长高速铁路--京沪高铁,列车时速高达380公里,车厢大部分采用铝合金材料制造,这是因为铝合金( )
| A. | 比纯铝熔点高 | |
| B. | 各种成分在自然界中含量丰富,容易获取 | |
| C. | 具有比较活泼的化学性质 | |
| D. | 质量轻,强度大,抗腐蚀能力比较强 |
9.欲制取较纯净的CH2ClCH2Cl,可采取的方法是( )
| A. | 乙烷与Cl2取代 | B. | 乙烯与Cl2加成 | ||
| C. | 乙醇与浓盐酸取代 | D. | 乙炔与HCl加成 |
 取1.38g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加4.42g;若将燃烧产物通过浓硫酸,浓硫酸质量增加0.9g;已知:A的蒸气对氢气的相对密度为69.
取1.38g由C、H、O三种元素组成的有机物A,在足量氧气中完全燃烧,若将燃烧产物通过碱石灰,碱石灰质量增加4.42g;若将燃烧产物通过浓硫酸,浓硫酸质量增加0.9g;已知:A的蒸气对氢气的相对密度为69. 在一定固定容积的密闭容器中,CO2(g)与一定量的C(s)发生进行如下化学反应:CO2(g)+C(s)?2CO(g).
在一定固定容积的密闭容器中,CO2(g)与一定量的C(s)发生进行如下化学反应:CO2(g)+C(s)?2CO(g).