题目内容
15.根据下列叙述写出相应的热化学方程式:
(1)已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫的燃烧的热化学方程式:S(s)+O2(g)=SO2(g)△H=-296.8kJ/mol.
(2)如图1是298K、101kPa时,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
(3)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得:
C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1
①若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1molH2O(g)和足量C(s),H2O(g)的平衡转化率为50%
②对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是a.
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
③上述反应达到平衡后,移走体系中部分C(s),平衡不移动,将产生的CO全部移走,平衡向右移(以上两空选填“向左移”、“向右移”、“不移动”).
④上述反应在t0时刻达到平衡(如图2),若在t1时刻改变某一条件,请在图2中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①增大容器体积(用实线表示) ②升高温度(用虚线表示)
分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)图象分析可知是1molN2与和3molH2完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,据此写出反应的热化学方程式;
(3)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;设H2O(g)的变化量为xmol,利用三行式确定平衡状态,根据平衡常数K=0.5,计算出x的值再确定H2O(g)转化率;
②增加反应速率的措施有升高温度、增大压强、增大浓度、使用催化剂,而要增加平衡体系中H2的百分含量,平衡需向正方向移动,结合勒夏特列原理判断各选项即可;
③平衡体系中改变固体的量,不影响反应速率,不影响平衡的移动;
④①增大容器体积,浓度减小,正反应速率立即减小;平衡右移,反应物浓度继续减小,据此分析正反应速率变化;
②升高温度,反应速率加快;平衡右移,反应物浓度继续减小,据此分析正反应速率变化.
解答 解:(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kj热量,则热化学方程式为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol;
(2)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.
(3)①C (s)+H2O(g)?CO (g)+H2 (g)的平衡常数K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$; 向体积为1L的密闭容器中加入1mol H2O(g)和足量C(s),设H2O(g)的变化量为xmol,则
C (s)+H2O(g)?CO (g)+H2 (g)
起始物质的量(mol) 1 0 0
变化物质的量(mol) x x x
起始物质的量(mol) 1-x x x
K=c(CO)•c(H2)/c(H2O)=x•x/(1-x)=0.5,解得x=0.5,则H2O(g)的转化率为$\frac{0.5mol}{1mol}$=50%,
故答案为:50%;
②a.升高温度反应速率增大且平衡正向移动,可以提高平衡体系中H2的百分含量,故a正确;
b.增大水蒸气的浓度,反应速率增大,生成H2的量增大,但可以平衡体系中H2的百分含量降低,故b错误;
c.加入催化剂反应速率增大,平衡不移动,故c错误;
d.降低压强,平衡正向移动,可以提高平衡体系中H2的百分含量,但反应速率降低,故d错误;故答案为:a;
③改变碳的量,不影响反应速率,不影响平衡的移动;将产生的CO全部移走,平衡右移.
故答案为:不移动;向右移;
④①增大容器体积,浓度减小,正反应速率立即减小;而增大容器体积后平衡右移,反应物浓度继续减小,故正反应速率在立即减小后会继续逐渐减小,故图象为: ,故答案为:
,故答案为: ;
;
②升高温度,反应速率加快;而升高温度后平衡右移,反应物浓度继续减小,故正反应速率在立即增大后会逐渐减小,故图象为: ,故答案为:
,故答案为: .
.
点评 本题考查化学平衡影响因素、平衡常数及应用等,注意理解掌握平衡常数应用,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )
如图所示,烧杯中的溶液为2mol•L-1CH3COOH溶液,接通直流电源,分别向烧杯中加入下列物质(保持反应温度不变),灯泡变暗的是( )| A. | 加入固体NaOH | B. | 加水稀释 | C. | 加入金属Na | D. | 通入HC1气体 |
| 方案 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |  |
| ① | 浓硝酸 | Na2S | AgCl溶液 | NaOH溶液 | |
| ② | 浓醋酸 | CaCO3 | NaOH溶液(过量) | Na2SiO3溶液 | |
| ③ | 浓盐酸 | KMnO4 | NaBr溶液 | KI溶液 | |
| ④ | 浓硫酸 | 蔗糖 | KMnO4溶液(过量) | 石灰水 |
| A. | 用①来验证溶解度:S(Ag2S)<S(AgCl) | |
| B. | 用②来验证酸性:CH3COOH>H2CO3>H2SiO3 | |
| C. | 用③来验证氧化性:KMnO4>Cl2>Br2>I2 | |
| D. | 用④来验证蔗糖与浓硫酸作用后有SO2和CO2产生 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的相差4 |
| F 是前四周期原子电子排布图中单电子数最多的元素 |
| G在周期表的第十一列 |
 .
.(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na(用元素符号填空).
(3)B、D的电负性相对大小:B大于D(用“大于”、“小于”或“等于”填空).
(4)以上六种元素中,位于s区的有1种,位于p区的有4种.
(5)DE3的电子式为
 .
. | A. | 16gO2占有的体积约为11.2L | |
| B. | 22.4LH2含有阿伏加德罗常数个氢分子 | |
| C. | 在标准状况下,44.8LH2O的质量约为36g | |
| D. | 11gCO2与标准状况下5.6LHCl含有相同的分子数 |

| A. | Fe电极的电极反应式为:Fe-2e-═Fe2+ | |
| B. | 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32- | |
| C. | 通入甲烷的石墨电极的电极反应式为:CH4+100H+-8e-═CO32-+7H2O | |
| D. | 为增强污水的导电能力,可向污水中加入适量工业用食盐 |
 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题: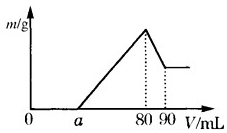 (1)把一定质量的镁、铝混合物投入到 2mol•L-1 的盐酸中,待金属完全溶解后,向溶液中加入 2mol•L-1 的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
(1)把一定质量的镁、铝混合物投入到 2mol•L-1 的盐酸中,待金属完全溶解后,向溶液中加入 2mol•L-1 的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: