题目内容
6.碳及其化合物有广泛的用途.(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
分析 (1)该反应是一个反应前后气体体积增大的吸热反应,升高温度、减小压强、减少生成物的量都能使平衡向正反应方向移动;
(2)利用盖斯定律构造目标热化学方程式,反应热也进行相应的运算;
(3)①正反应放热,降温时平衡正向移动;
②平衡常数表达式为K=$\frac{生成物浓度的幂次方}{反应物浓度的幂次方}$;
③反应前后气体体积不变,等比例加入反应物,平衡与原平衡等效;
解答 解:(1)A.增加碳的用量,浓度不变,平衡不移动,故错误;
B.升高温度,平衡正向移动,H2产率增大,故正确;
C.用CO吸收剂除去CO,平衡正向移动,H2产率增大,故正确;
D.加入催化剂,平衡不移动,故错误;
故选:BC;
(2)已知:①C(s)+H2O(g)?CO(g)+H2(g),△H=+131.3kJ•mol-1,
②C(s)+CO2(g)?2CO(g),△H=+172.5kJ•mol-1
根据盖斯定律,①-②得:CO(g)+H2O(g)?CO2(g)+H2(g),△H=131.3kJ•mol-1-172.5kJ•mol-1=-41.2kJ•mol-1,
故答案为:-41.2kJ•mol-1;
(3)①正反应放热,降温时平衡正向移动,v(正)>v(逆),
故答案为:<;
②CO和H2O反应了0.06mol,则CO2和H2生成了0.06mol,平衡时各物质的浓度为:反应物CO和H2O为0.05mol/L,生成物CO2和H2为0.03mol/L,平衡常数表达式为K=$\frac{生成物浓度的幂次方}{反应物浓度的幂次方}$=$\frac{0.03mol/L×0.03mol/L}{0.05mol/L×0.05mol/L}$=$\frac{9}{25}$,
故答案为:$\frac{9}{25}$;
③反应前后气体体积不变,与原平衡等比例加入反应物,平衡与原平衡等效,所以,平衡时各物质的浓度与原判断相同,
故答案为:不变.
点评 本题主要考查了平衡移动、盖斯定律应用、平衡常数的计算、等效平衡,题目难度中等.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | 水 | B. | 盐酸 | C. | 氢氧化钠溶液 | D. | 硝酸银溶液 |
| 物 质 | 试 剂 | |
| A | Na2SO4溶液(NaBr) | Cl2 |
| B | FeCl2 溶液(FeCl3) | Cu |
| C | CO2(CO) | 通入O2燃烧 |
| D | CO2(HCl) | 饱和NaHCO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 水分子不可再分 | |
| B. | 水分子由氢和氧两种元素组成 | |
| C. | 水分子由氧原子和氢原子构成 | |
| D. | 二氧化碳分子是保持干冰化学性质的最小微粒 |

| A. | 该有机物属于氨基酸 | |
| B. | 该有机物的分子式为C3H7NO2 | |
| C. | 该有机物与CH3CH2CH2NO2互为同分异构体 | |
| D. | 一定条件下不能生成高分子化合物 |
| A. | ①②③ | B. | ②③④ | C. | ①②⑤ | D. | ③④⑤ |
| A. | 大量使用燃煤发电是形成雾霾的主要原因之一 | |
| B. | 天然气、煤气大量泄漏遇到明火会爆炸 | |
| C. | 利用化学反应可实现12C到14C的转化 | |
| D. | 因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 |
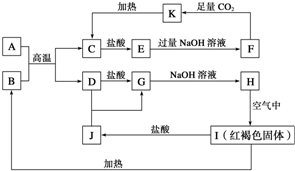 已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A是铝,且A+B→C+D是置换反应,反应过程中生成的水及其他部分产物已略去.
已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A是铝,且A+B→C+D是置换反应,反应过程中生成的水及其他部分产物已略去.