题目内容
12.下列反应中,不属于氧化还原反应的是( )| A. | H2+F2═2HF | B. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+4NO2↑+O2↑ |
分析 氧化还原反应的实质为电子的转移,特征为化合价升降,则反应中存在化合价变化的反应为氧化还原反应,没有化合价变化的反应为非氧化还原反应,据此进行解答.
解答 解:A.H2+F2═2HF中存在H、F元素的化合价变化,属于氧化还原反应,故A不选;
B.反应3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2中存在C、Fe元素的化合价变化,属于氧化还原反应,故B不选;
C.NaOH+HCl═NaCl+H2O为复分解反应,反应中没有元素化合价变化,不属于氧化还原反应,故C选;
D.4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+4NO2↑+O2↑中存在N、O元素的化合价变化,属于氧化还原反应,故D不选;
故选C.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握常见反应类型与氧化还原反应的关系,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
20.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,22.4LSO3所含的分子数为NA | |
| B. | 49g硫酸中所含氧原子的数目为2NA | |
| C. | 1molNH4+所含质子数为10NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
17.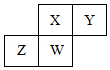 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
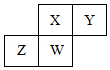 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )| A. | 最简单气态氢化物的热稳定性:Y>X>W>Z | |
| B. | 最高价氧化物对应的水化物的酸性:X>W>Z | |
| C. | 原子半径:W>Z>Y>X | |
| D. | 元素X、Z、W的最高正价分别与其主族序数相等 |
4.200mL P%的盐酸(密度为ρg/cm3),其物质的量浓度的计算式正确的是( )
| A. | $\frac{200×P%×ρ}{36.5}$ | B. | $\frac{1000×P%×ρ}{36.5}$ | C. | $\frac{200×P%}{36.5}$ | D. | $\frac{ρ×P%}{1000×36.5}$ |
1.能用离子方程式H++SO42-+OH-+Ba2+═BaSO4↓+H2O 来表示的反应是( )
| A. | 等物质的量浓度等体积的稀硫酸和氢氧化钡溶液反应 | |
| B. | 稀硫酸和过量氢氧化钡溶液反应 | |
| C. | 硫酸氢钠溶液和过量氢氧化钡溶液反应 | |
| D. | 硫酸氢钠溶液和少量氢氧化钡溶液反应 |
8.N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如下表:
(1)写出光气(COCl2)的电子式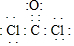
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).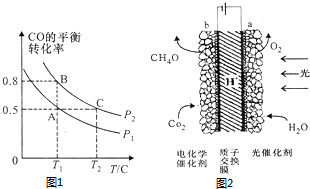
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
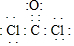
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).

A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
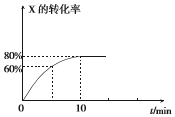 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应: