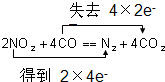题目内容
18.下列物质能使酸性高锰酸钾溶液褪色,但不能使溴的CCl4 溶液褪色的是( )| A. | 乙烯 | B. | 苯 | C. | 甲苯 | D. | 乙酸 |
分析 由选项中物质可知,能使酸性高锰酸钾溶液褪色但不能发生化学反应使溴水褪色的是应为苯的同系物,以此来解答.
解答 解:A.乙烯中含C=C,能使酸性高锰酸钾溶液褪色,也能发生化学反应使溴水褪色,故A不选;
B.苯与溴水、高锰酸钾均不反应,均不能使其褪色,故B不选;
C.甲苯能被高锰酸钾氧化,与溴水不反应,则能使酸性高锰酸钾溶液褪色但不能发生化学反应使溴水褪色,故C选;
D.乙酸与溴水、高锰酸钾都不反应,故D不选,
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃、苯及其同系物的性质,萃取为解答的易错点,题目难度不大.

练习册系列答案
相关题目
8.N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如下表:
(1)写出光气(COCl2)的电子式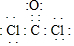
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).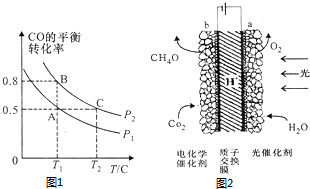
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
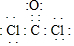
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).

A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
9.8g无水硫酸铜配成0.1mol•L-1的水溶液.下列说法正确的是( )
| A. | 溶于500 mL水中 | B. | 溶于1 L水中 | ||
| C. | 溶解后溶液的总体积为500 mL | D. | 溶解后溶液的总体积为1 L |
6.下面叙述正确的是( )
| A. | 同质量H2与Cl2,H2的分子数比Cl2多 | |
| B. | 摩尔是用来衡量微观粒子多少的物理量 | |
| C. | 0.1molH2SO4含有氢原子数的精确值为1.204×1023 | |
| D. | 0.5mol氢的质量是0.5g |
13.下列溶液对水的电离平衡不产生影响的是( )
| A. | NaHSO4溶液 | B. | KOH溶液 | C. | Na2SO4 | D. | NH4Cl溶液 |
10.减缓温室气体排放是2009年哥本哈根气候变化会议的议题.下列反应不产生温室气体的是( )
| A. | 用氨制碳酸氢铵 | B. | 制普通玻璃 | ||
| C. | 用铁矿石炼铁 | D. | 汽车用乙醇汽油作燃料 |
7.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA | |
| B. | 足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA | |
| C. | 密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA | |
| D. | 常温常压下,92 g的NO2和N2O4混合气体含有的氧原子数为3NA |
7.已知化学反应:O2(g)+2SO2(g)?2SO3(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$.
(2)某温度下,平衡浓度符合下式:c2(SO3)=c(O2)•c2(SO2),试判断此时的温度为830℃.
(3)设在一定体积的密闭容器中充入0.30mol O2(g)和0.60mol SO2(g),反应在一定条件下达到平衡时,SO3的物质的量分数(SO3的物质的量与反应体系中总的物质的量之比)为$\frac{4}{7}$,该条件下O2的平衡转化率为$\frac{2}{3}$;该条件下反应2SO3(g)?O2(g)+2SO2(g)的平衡常数K=40.
(4)当O2与SO2混合气体以不同比例混合时,测得其平均相对分子质量分别为57.6和44.8,取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,分别求出O2在上述混合气体中的体积分数20%、60%.
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{{c}^{2}(S{O}_{3})}{c({O}_{2})•{c}^{2}(S{O}_{2})}$.
(2)某温度下,平衡浓度符合下式:c2(SO3)=c(O2)•c2(SO2),试判断此时的温度为830℃.
(3)设在一定体积的密闭容器中充入0.30mol O2(g)和0.60mol SO2(g),反应在一定条件下达到平衡时,SO3的物质的量分数(SO3的物质的量与反应体系中总的物质的量之比)为$\frac{4}{7}$,该条件下O2的平衡转化率为$\frac{2}{3}$;该条件下反应2SO3(g)?O2(g)+2SO2(g)的平衡常数K=40.
(4)当O2与SO2混合气体以不同比例混合时,测得其平均相对分子质量分别为57.6和44.8,取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,分别求出O2在上述混合气体中的体积分数20%、60%.