题目内容
17.以苯为原料,不能通过一步反应制得的有机物是( )| A. | 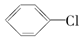 | B. | 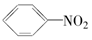 | C. | 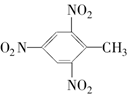 | D. |  |
分析 苯分子中不含碳碳双键,碳碳键是介于单键与双键之间独特的化学键,苯能够与液氯发生取代反应,与硝酸发生硝化反应,与氢气发生加成反应,以此解答该题.
解答 解:A.苯和氯气能发生取代反应生成氯苯,故A正确;
B.苯与浓硝酸一定条件下能够发生取代反应生成硝基苯,故B正确;
C.苯应先生成甲苯,然后再生成三硝基甲苯,不能由苯一步反应制得,故C错误;
D.苯一定条件下可以与氢气发生加成反应生成环己烷,故D正确.
故选C.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目着眼于双基的考查,有利于培养学生良好的科学素养,注意把握苯的结构和性质,

练习册系列答案
相关题目
1.能用离子方程式H++SO42-+OH-+Ba2+═BaSO4↓+H2O 来表示的反应是( )
| A. | 等物质的量浓度等体积的稀硫酸和氢氧化钡溶液反应 | |
| B. | 稀硫酸和过量氢氧化钡溶液反应 | |
| C. | 硫酸氢钠溶液和过量氢氧化钡溶液反应 | |
| D. | 硫酸氢钠溶液和少量氢氧化钡溶液反应 |
8.N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如下表:
(1)写出光气(COCl2)的电子式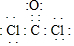
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).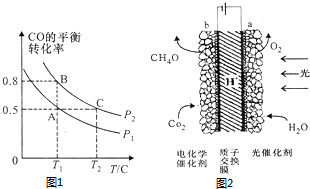
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
Ⅰ、CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如下表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
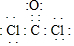
(2)上表是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况,用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).

A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ.甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kJ/mol、726.83kJ/mol、285.2kJ/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:
某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH)
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
9.8g无水硫酸铜配成0.1mol•L-1的水溶液.下列说法正确的是( )
| A. | 溶于500 mL水中 | B. | 溶于1 L水中 | ||
| C. | 溶解后溶液的总体积为500 mL | D. | 溶解后溶液的总体积为1 L |
6.下面叙述正确的是( )
| A. | 同质量H2与Cl2,H2的分子数比Cl2多 | |
| B. | 摩尔是用来衡量微观粒子多少的物理量 | |
| C. | 0.1molH2SO4含有氢原子数的精确值为1.204×1023 | |
| D. | 0.5mol氢的质量是0.5g |
7.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA | |
| B. | 足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA | |
| C. | 密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA | |
| D. | 常温常压下,92 g的NO2和N2O4混合气体含有的氧原子数为3NA |
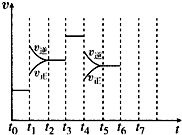 在一密闭容器中发生反应N2+3H2 2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2 2NH3△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: