题目内容
10.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3.有关叙述正确的是( )| A. | 结合H+的能力:Y>CO${\;}_{3}^{2-}$>X>HCO${\;}_{3}^{-}$ | |
| B. | 三种酸的电离常数Ki(HX)>Ki(HY)>Ki(H2CO3) | |
| C. | 溶液碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO${\;}_{3}^{-}$)>c (X)>c(OH)>c(H+) |
分析 根据题意写出方程式:
CO2+H2O+NaX=HX+NaHCO3;HX+Na2CO3=NaHCO3+NaX;
CO2+H2O+2NaY=2HY+Na2CO3;NaHCO3+NaY=HY+Na2CO3;
利用强酸制弱酸的原理判断出酸性:H2CO3>HX>NaHCO3>HY,
碱性强弱可以利用越弱越水解判断:NaHCO3<NaX<Na2CO3<NaY,据此分析.
解答 解:A.由A可知酸性H2CO3>HX>NaHCO3>HY,则结合质子能力:Y->CO32->X->HCO3-,故A正确;
B.向NaX溶液中通入CO2气体,只能生成HX和NaHCO3,则酸性H2CO3>HX>NaHCO3,向NaY溶液中通入CO2,只生成HY和Na2CO3,则酸性NaHCO3>HY,则有酸性由强到弱:H2CO3>HX>HCO3->HY,酸性越强,电离常数越大,所以三种酸的电离常数:Ki1(H2CO3)>Ki(HX)>Ki2(H2CO3)>Ki(HY),故B错误;
C.酸性H2CO3>HX>NaHCO3>HY,碱性强弱可以利用越弱越水解判断,所以溶液的碱性:NaHCO3<NaX<Na2CO3<NaY,故C错误;
D.向NaX溶液中通入足量CO2后生成HX,由于HX发生电离,则c(Na+)>c(X-),由于酸性HX>HCO3-,则c(HCO3-)>c(HX)>c(X-),则c(Na+)>c(HCO3-)>c(HX)>c(X-)>c(OH-),由于酸性:H2CO3>HX>NaHCO3,溶液应显酸性,c(OH)<c(H+),故D错误.
故选A.
点评 本题考查离子浓度的大小比较,题目难度较大,注意根据通入二氧化碳的反应判断酸的强弱是解答该题的关键,做题时注意体会.

练习册系列答案
相关题目
7.下列离子反应方程式正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 将金属Na加入冷水中:2 Na+2 H2O═2 Na++2 OH-+H2↑ | |
| C. | 盐酸滴入澄清石灰水:Ca(OH)2+2 H+═Ca2++2 H2O | |
| D. | 澄清石灰水吸收氯气:Cl2+OH-═Cl-+ClO-+H+ |
15.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 80mL 10mol/L的浓盐酸与足量的MnO2加热反应,产生Cl2分子数为0.2NA | |
| B. | 25g质量分数为68%的H2O2水溶液中含氧原子数目为NA | |
| C. | 1L 1mol/L的Fe2(SO4)3溶液中含有的SO42-离子数为3NA | |
| D. | 常温常压下,等质量的CO和N2中含有的原子数目均为2NA |
2.下列各组中两种气体所含的原子数一定相等的是( )
| A. | 温度相同,体积相同的O2和N2 | |
| B. | 质量相等,密度不等的N2和CO | |
| C. | 体积相等,密度相等的CO和C2H4 (C2H4 为乙烯气体) | |
| D. | 压强相同、体积相同的N2和O2 |
19.下列反应中,NH3既显还原性,又显碱性的是( )
| A. | NH3+HCl═NH4Cl | B. | 4NH3+5O2$\frac{\underline{\;Pt\;}}{△}$4NO+6H2O | ||
| C. | 3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O | D. | 8NH3+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$6NH4Cl+N2 |
20.若实验室仅有锥形瓶、长颈漏斗、导管、胶管、烧杯、药匙,据此只能制备下列哪组气体( )
| A. | C2H2、H2S、C2H4 | B. | H2、CO2、H2S | C. | HCl、CO2、O2 | D. | H2、NO2、CH4 |
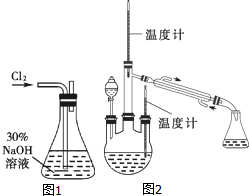 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl