题目内容
2.下列各组中两种气体所含的原子数一定相等的是( )| A. | 温度相同,体积相同的O2和N2 | |
| B. | 质量相等,密度不等的N2和CO | |
| C. | 体积相等,密度相等的CO和C2H4 (C2H4 为乙烯气体) | |
| D. | 压强相同、体积相同的N2和O2 |
分析 A.温度、体积相同条件下,影响气体分子数目的因素有压强,二者所处压强不一定相等;
B.氮气和一氧化碳的摩尔质量相等,质量相等时物质的量相等,结合分子含有原子数目进行解答;
C.体积和密度相等,则两气体的质量相等,由于摩尔质量相等,则两者的物质的量相等,结合分子含有原子数目进行解答;
D.压强、体积相同条件下,影响气体分子数目的因素有温度,二者所处温度不一定相等.
解答 解:A.温度、体积相同条件下,影响气体分子数目的因素有压强,压强不一定相等,则两气体的物质的量不一定相等,二者都是双原子分子,故含有的原子数目不一定相等,故A错误;
B.氮气和一氧化碳的摩尔质量相等,质量相等时物质的量相等,二者都是双原子分子,故原子数一定相等,故B正确;
C.体积和密度相等,则两气体的质量相等,由于摩尔质量相等,则两者的物质的量相等,二者原子数之比为1:3,故含有原子数目之比为1:3,故C错误;
D.压强、体积相同条件下,影响气体分子数目的因素有温度,二者所处温度不一定相等,则原子数不一定相等,故D错误;
故选B.
点评 考查阿伏伽德罗定律及推论、原子数目的计算等,难度中等,注意根据pV=nRT理解.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
19.甲烷和氯气的混合气体在光照条件下发生反应,生成氯化氢、一氯甲烷、二氯甲烷、三氯甲烷和四氯甲烷.下列有关说法正确的是( )
| A. | 该反应既是取代反应又是置换反应 | |
| B. | 一氯甲烷的电子式是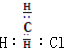 | |
| C. | 二氯甲烷分子有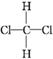 和 和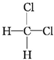 两种空间结构 两种空间结构 | |
| D. | 三氯甲烷和四氯甲烷是工业上重要的溶剂 |
13.下列关于NA说法正确的是( )
| A. | 常温常压下,11.2 L甲烷中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3 mol二氧化碳中含有氧原子数为0.3 NA | |
| C. | 常温下,2.7 g铝与足量的盐酸反应,失去的电子数0.3 NA | |
| D. | 常温下,0.1 mol/L MgCl2溶液中含Cl-数为0.2 NA |
10.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3.有关叙述正确的是( )
| A. | 结合H+的能力:Y>CO${\;}_{3}^{2-}$>X>HCO${\;}_{3}^{-}$ | |
| B. | 三种酸的电离常数Ki(HX)>Ki(HY)>Ki(H2CO3) | |
| C. | 溶液碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO${\;}_{3}^{-}$)>c (X)>c(OH)>c(H+) |
17.关于反应Al2O3+N2+3C═2AlN+3CO,下列说法错误的是( )
| A. | AlN是氧化产物,其中N是+3价 | B. | 氧化剂是N2,还原剂是C | ||
| C. | Al2O3既不是氧化剂,也不是还原剂 | D. | 每生成2mol AlN,有6mol电子转移 |
7.已知M(C8Hl602)发生水解反应可生成A、B两种化合物,在一定条件下A可转化为B,则所有A、B反应生成的物质有( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
14.对下列事实的解释,错误的是( )
| A. | 常温下,浓H2SO4可以用铝(或铁)容器贮存,说明浓H2SO4与Al(或Fe)常温下不反应 | |
| B. | 在蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性 | |
| C. | 浓H2SO4能使胆矾由蓝变白,说明浓H2SO4具有吸水性 | |
| D. | 稀H2SO4能与Fe反应产生H2,说明稀H2SO4也有氧化性 |
11.铝灰的回收利用方法很多,现用含有A12O3、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O,工艺流程如图:
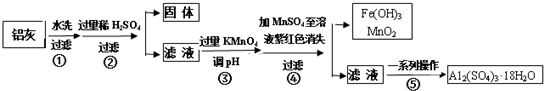
请回答下列问题:
(1)加入过量稀H2SO4溶解A12O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
步骤③的目的是亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去;若在该浓度下除去铁的化合物,调节pH的最大范围是2.8≤PH<3.4.
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2+4H+;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是浓盐酸或双氧水.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B (填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.

请回答下列问题:
(1)加入过量稀H2SO4溶解A12O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2+4H+;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是浓盐酸或双氧水.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B (填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.
12.等质量的SO2和SO3 中,下列说法正确的是( )
| A. | 所含氧原子的个数比为2:3 | B. | 所含硫原子的个数比为1:1 | ||
| C. | 所含氧元素的质量比为5:6 | D. | 所含硫元素的质量比为5:4 |