题目内容
18.在标准状况下,将过量的铜粉投入到100ml某稀HNO3中,用排水法收集到1.12L气体,则该稀硝酸的物质的量浓度为?(写出计算过程)分析 发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,计算NO物质的量,根据方程式计算HNO3的物质的量,再根据c=$\frac{n}{V}$计算硝酸物质的量浓度.
解答 解:标况下,11.2L NO的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
8 2
n(HNO3) 0.05mol
所以n(HNO3)=$\frac{0.05mol×8}{2}$=0.2mol
则c(HNO3)=$\frac{0.2mol}{0.1L}$=2mol/L
答:该稀硝酸的物质的量浓度为2mol/L.
点评 本题考查化学方程式计算,比较基础,明确反应的反应即可解答,掌握以物质的量有关的计算,有利于基础知识的巩固.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 一定温度下,反应 MgCl2(l)═Mg(l)+Cl2(g)的△H>0、△S>0 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 在H2S溶液中,C(H+)和C(S2-)的比值为2:1 | |
| D. | 1 mol/L和0.1 mol/L的两瓶氨水中c(OH-)之比为10:1 |
13.下列关于NA说法正确的是( )
| A. | 常温常压下,11.2 L甲烷中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3 mol二氧化碳中含有氧原子数为0.3 NA | |
| C. | 常温下,2.7 g铝与足量的盐酸反应,失去的电子数0.3 NA | |
| D. | 常温下,0.1 mol/L MgCl2溶液中含Cl-数为0.2 NA |
3.表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍.下列说法正确的是( )
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z元素的原子半径依次减小 | |
| B. | Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | YX2晶体熔化、液态WX3气化均需克服分子间作用力 | |
| D. | 根据元素周期律,可以推测T2X3具有氧化性和还原性 |
10.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3.有关叙述正确的是( )
| A. | 结合H+的能力:Y>CO${\;}_{3}^{2-}$>X>HCO${\;}_{3}^{-}$ | |
| B. | 三种酸的电离常数Ki(HX)>Ki(HY)>Ki(H2CO3) | |
| C. | 溶液碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO${\;}_{3}^{-}$)>c (X)>c(OH)>c(H+) |
7.已知M(C8Hl602)发生水解反应可生成A、B两种化合物,在一定条件下A可转化为B,则所有A、B反应生成的物质有( )
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
8.只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是( )
| 甲 | 乙 | |
| ① | 物质微粒数 | 阿伏加德罗常数 |
| ② | 标况下气体摩尔体积 | 标况下气体体积 |
| ③ | 溶剂的体积 | 溶质的物质的量浓度 |
| ④ | 溶液中溶质的质量分数 | 溶液的质量 |
| ⑤ | 非标况下物质的质量 | 物质的摩尔质量 |
| A. | ③ | B. | ③④ | C. | ②③④ | D. | ③④⑤ |
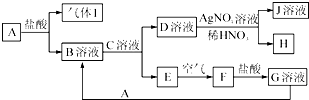 已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色,各物质之间的转化关系如图所示.
已知A~J都是中学化学中的常见物质,其中A、I为单质,E、H是白色沉淀,F为红褐色沉淀,J溶液的焰色反应(透过蓝色的钴玻璃观察)呈紫色,各物质之间的转化关系如图所示. .
.