题目内容
5.(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应的化学方程式为NaCl(s)+H2SO4(浓) $\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑.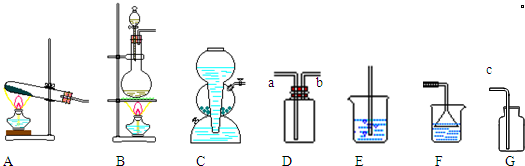
(2)氯化氢气体的发生装置应该选择装置B(填装置的编号,下同).由于氯化氢气体有害,所以实验室用装置D来收集氯化氢.收集氯化氢时,气体从a管(填a或b或c)进入.用水吸收多余的氯化氢气体时,应该选择装置F,这是为了防止水倒吸入集气瓶.
(3)为了比较盐酸溶液与氯化氢气体性质的不同之处,取两支试管,一支滴入2~3mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一片干燥的蓝色石蕊试纸.观察到的现象是盐酸中石蕊试纸变红,干燥氯化氢中试纸不变色.再取两支试管,一支滴入2~3mL盐酸,另一支收集干燥的氯化氢气体并塞好橡皮塞,然后各放入一小块锌片.观察到的现象是盐酸中锌片溶解,有气泡产生,氯化氢中锌片无变化.
分析 (1)用食盐晶体与浓硫酸在微热条件下反应生成氯化氢气体和硫酸氢钠;
(2)实验室利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,是固体+固体$\frac{\underline{\;\;△\;\;}}{\;}$气体,选择装置B;氯化氢是比空气重的极易溶于水的气体需要用向上排气法收集,导气管长进短处,多余的氯化氢气体用水吸收要防止倒吸;
(3)盐酸是氯化氢气体的水溶液电离出氢离子显酸性,干燥的氯化氢是氯化氢分子无氢离子.
解答 解:(1)实验室用食盐晶体与浓硫酸在微热条件下反应制取氯化氢气体,反应生成氯化氢气体和硫酸氢钠,反应的化学方程式为NaCl(s)+H2SO4(浓)$\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑,故答案为:NaCl(s)+H2SO4(浓)$\frac{\underline{\;微热\;}}{\;}$NaHSO4+HCl↑;
(2)实验室利用二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水,是固体+固体$\frac{\underline{\;\;△\;\;}}{\;}$气体,选择装置B;氯化氢是比空气重的极易溶于水的气体需要用向上排气法收集,选择装置D收集气体,导气管长进短处,应从a处进,多余的氯化氢气体用水吸收要防止倒吸,应选择装置F防止水倒吸入集气瓶,
故答案为:B;D;a;F;水倒吸入集气瓶;
(3)盐酸是氯化氢气体的水溶液电离出氢离子显酸性,干燥的氯化氢是氯化氢分子无氢离子,各放入一片干燥的蓝色石蕊试纸,盐酸溶液中石蕊试纸变红色,干燥的氯化氢气体中试纸无变化,各放入一小块锌片,盐酸中锌片溶解,反应生成氢气,氯化氢气体中无变化,
故答案为:盐酸中石蕊试纸变红,干燥氯化氢中试纸不变色;盐酸中锌片溶解,有气泡产生,氯化氢中锌片无变化.
点评 本题考查了实验室制备氯化氢、氯气的实验装置和试剂选择,注意盐酸和氯化氢气体的性质区别,掌握物质性质和基础是解题关键,题目难度中等.

| A. | 在常温常压下,11.2 L氧气所含的分子数为0.5NA | |
| B. | 在常温常压下,1molHe的体积为22.4 L | |
| C. | 32 g氧气所含的原子数目为2NA | |
| D. | 在同温同压下,相同体积的任何气体所含的原子数相等 |
| A. | 常温常压下,11.2 L甲烷中含有的氢原子数为2NA | |
| B. | 标准状况下,0.3 mol二氧化碳中含有氧原子数为0.3 NA | |
| C. | 常温下,2.7 g铝与足量的盐酸反应,失去的电子数0.3 NA | |
| D. | 常温下,0.1 mol/L MgCl2溶液中含Cl-数为0.2 NA |
| A. | 上述反应中氧化产物只有N2 | |
| B. | 经测定,NaCN的水溶液呈碱性,说明CN-能促进水的电离 | |
| C. | 若上述反应生成0.4molCO2,则溶液中阴离子增加的物质的量为2mol | |
| D. | 现取1L含CN-1.04mg/L的废水,理论需用4.010-5molCl2处理 |
| A. | 结合H+的能力:Y>CO${\;}_{3}^{2-}$>X>HCO${\;}_{3}^{-}$ | |
| B. | 三种酸的电离常数Ki(HX)>Ki(HY)>Ki(H2CO3) | |
| C. | 溶液碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO${\;}_{3}^{-}$)>c (X)>c(OH)>c(H+) |
| A. | AlN是氧化产物,其中N是+3价 | B. | 氧化剂是N2,还原剂是C | ||
| C. | Al2O3既不是氧化剂,也不是还原剂 | D. | 每生成2mol AlN,有6mol电子转移 |
| A. | 常温下,浓H2SO4可以用铝(或铁)容器贮存,说明浓H2SO4与Al(或Fe)常温下不反应 | |
| B. | 在蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性 | |
| C. | 浓H2SO4能使胆矾由蓝变白,说明浓H2SO4具有吸水性 | |
| D. | 稀H2SO4能与Fe反应产生H2,说明稀H2SO4也有氧化性 |