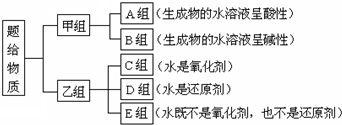
题目内容
15.乙酸是重要的有机化工原料之一,目前世界上一半以上的乙酸都采用甲醇与CO 反应来制备.某实验小组在一个恒压密闭容器中加入 0.20mol CH3OH 和 0.22mol CO 气体,发生反应 CH3OH(g)+CO(g)?CH3COOH(l),测得甲醇的转化率随温度的变化关系如图1所示,其中曲线Ⅰ表示在 5 个不同温度下,均经过 5min 时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在 T2温度下,达到平衡时容器的体积刚好为 2L.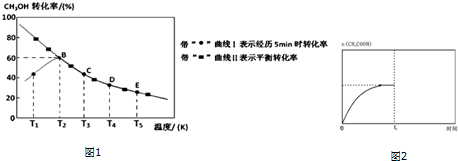
已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ.mol-1
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1529kJ•mol-1
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-874kJ•mol-1按要求回答下列问题:
(1)CH3OH(g)+CO(g)?CH3COOH(l)△H=-175kJ•mol-1
(2)在温度为 T2时,从反应开始至 5min 时,用单位时间内物质的量变化…表示的乙酸的平均反应速率为0.024mol•min-1.
(3)在温度为 T2时,该反应的平衡常数 K=500;在 T3温度下,C 点时,ν(正)=ν(逆) (填“>”、“<”或“=”).
(4)曲线Ⅰ在 T1~T2阶段,甲醇转化率随温度变化升高的原因是反应未达平衡状态,故升高温度,化学反应速率加快,故甲醇转化率随温度的升高而增大;
(5)在温度为 T2时,往上述已达到平衡的恒压容器中,再在瞬间通入 0.12mol CH3OH和0.06molCO 混合气体,平衡的移动方向为不移动(填“向左”或“向右”或“不移动”),理由是加入气体的总物质的量与原平衡气体的总物质的量相等,体积变为4L,Qc=$\frac{1}{\frac{0.2×0.16}{4}}$=500=K
(6)在温度为 T1时,乙酸的物质的量随时间变化的趋势曲线如图2所示.在 t1时,将该反应体系温度上升到 T3,并维持该温度.请在图中画出 t1时刻后乙酸物质的量变化总趋势曲线.
分析 (1)根据盖斯定律进行计算,由(②+①)÷2-③得出正确结论,反应自发进行的判断依据是△H-T△S<0,反应能自发进行;
(2)由曲线Ⅰ可知:T2温度下,5min时测得的甲醇的转化率为60%,故转化的甲醇的物质的量为0.20mol×60%=0.12mol,则生成乙酸的物质的量为0.12mol,根据v=$\frac{△c}{△t}$进行计算;
(3)根据甲醇的转化率计算平衡时各物质的浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算平衡常数;平衡状态时,正逆反应速率相等;
(4)由曲线Ⅰ可知:T1-T2阶段,5min时,反应未达平衡状态,故升高温度,化学反应速率加快,甲醇转化率随温度的升高而增大;
(5)根据浓度商与平衡常数的大小关系,判断反应进行的方向,原平衡体系,气体总的物质的量为0.08mol+0.1mol=0.18mol,体积为2L,在温度为T2时,往上述达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,充入气体总的物质的量为0.12mol+0.06mol=0.18mol,原平衡相等,故体积变为原来的2倍,此时,甲醇的物质的量为0.08mol+0.12mol=0.2mol,CO的物质的量为0.1mol+0.06mol=0.16mol;
(6)当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度,温度升高,平衡逆向移动,乙酸的物质的量减小,一段时间后达到平衡状态,乙酸的物质的量保持不变,据此画出变化图象.
解答 解:(1)①2CO(g)+O2(g)=2CO2(g)△H=-560kJ•mol-1
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1530kJ•mol-1
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870kJ•mol-1
由(②+①)÷2-③得,CH3OH(g)+CO(g)?CH3COOH(l)△H=$\frac{(-560KJ/mol)+(-1530KJ/mol)}{2}$-(-870kJ•mol-1)=-175kJ•mol-1,
CH3OH(g)+CO(g)?CH3COOH(l)△H=-175kJ•mol-1,△H<0,△S<0,则满足△H-T△S<0的条件是低温下反应自发进行,
故答案为:-175;
(2)由曲线Ⅰ可知:T2温度下,5min时测得的甲醇的转化率为60%,故转化的甲醇的物质的量为0.20mol×60%=0.12mol,则生成乙酸的物质的量为0.12mol,故在温度为T3时,从反应开始至5min时,用单位时间内物质的量变化表示的乙酸的平均反应速率为=0.12/5=0.024mol•min-1,
故答案为:0.024;
(3)由解答(2)可知:在温度为T2时,转化的甲醇的物质的量为0.12mol,则转化的CO的物质的量为0.12mol,故平衡时甲醇的物质的量为0.20mol-0.12mol=0.08mol,CO的物质的量为0.22mol-0.12mol=0.1mol,故平衡常数K=$\frac{1}{[C{H}_{3}OH][CO]}$=$\frac{1}{\frac{0.08×0.1}{2}}$=500;
在T3温度下,C点时反应已达平衡状态,故正逆反应速率相等,故v(正)=v(逆),
故答案为:500;=;
(4)由曲线Ⅰ可知:T1温度下,5min时,反应未达平衡状态,故升高温度,化学反应速率加快,故甲醇转化率随温度的升高而增大,
故答案为:反应未达平衡状态,故升高温度,化学反应速率加快,故甲醇转化率随温度的升高而增大;
(5)原平衡体系,气体总的物质的量为0.08mol+0.1mol=0.18mol,体积为2L,在温度为T2时,往上述达到平衡的恒压容器中,再在瞬间通入0.12molCH3OH和0.06molCO混合气体,充入气体总的物质的量为0.12mol+0.06mol=0.18mol,原平衡相等,故体积变为原来的2倍,此时,甲醇的物质的量为0.08mol+0.12mol=0.2mol,CO的物质的量为0.1mol+0.06mol=0.16mol,则Qc=$\frac{1}{\frac{0.2×0.16}{4}}$=500=K,故平衡不移动;
故答案为:不移动;加入气体的总物质的量与原平衡气体的总物质的量相等,体积变为4L,Qc=$\frac{1}{\frac{0.2×0.16}{4}}$=500=K;
(6)当时间到达t1时,将该反应体系温度迅速上升到T3,并维持该温度,温度升高,平衡逆向移动,乙酸的物质的量减小,一段时间后达到平衡状态,乙酸的物质的量保持不变,故t1时刻后的变化总趋势曲线为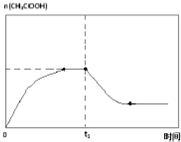 ,故答案为:
,故答案为: .
.
点评 本题考查盖斯定律的应用、平衡图象分析、平衡常数的计算机化学平衡移动原理,难度较大.要注意根据浓度商与平衡常数来判断反应进行的方向.

(1)在该厂所排污水中放置细铁网可获得金属铜,其原理是Fe+Cu2+=Fe2++Cu(用离子方程式表示).
(2)铜超标污水中还可能大量存在的阴离子是C、D.
A.CO32- B.OH- C.Cl- D.SO42-
(3)检测部门对该厂所排废水的检测数据如下:
| 次数 | 测量项目 | 测量数据(mg/mL) |
| 1 | 铜离子含量 | 4.224 |
| 2 | 4.225 | |
| 3 | 4.223 | |
| 4 | 2.005 |
②若要使该厂废水排放达标,应控制的最小pH=9.2.(已知25℃时,Ksp[Cu(OH)2]=2.2×10-20)
(4)该厂废水可以“变废为宝”,其流程图如下:

①高浓度的含铜废水经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可以得到纯度较高的铜盐晶体.
②用较高浓度含铜废水点解制铜,其阴极的电极反应式是Cu2++2e-=Cu;电解5L该厂排放的含铜废水,理论上可以得到铜21.12g.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 第2周期 | ① | ② | ③ | |||||
| 第3周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第4周期 | ⑨ | ⑩ |
(2)在①~⑩元素中,金属性最强的元素是K(填元素符号),气态氢化物能与其最高价氧化物对应的水化物发生反应生成盐的元素是N(填元素符号).
(3)元素⑥与元素⑦相比,⑦的非金属性较强,下列表述中能证明这一事实的是bd.
a.常温下⑥的单质和⑦的单质状态不同
b.⑦的氢化物比⑥的氢化物稳定
c.一定条件下⑥和⑦的单质都能与氢氧化钠溶液反应
d.一定条件下⑥和⑦的单质与Fe反应的产物不同
(4)⑤的单质可以与⑨的最高价氧化物的水化物的溶液反应,若将该反应设计成原电池,其负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O.
| A. | 利用H++OH-═H2O來测量某氢氧化钠溶液的浓度时:甲基橙--橙色 | |
| B. | 利用“2Fe3++2I-═I2+2Fe2+,用NaI溶液测量Fe(NO3)3样品中Fe(NO3)3百分含量:淀粉--蓝色 | |
| C. | 利用“Ag++SCN-=AgSCN↓原理,可用标准KSCN溶液含量AgNO3溶液浓度:Fe(NO3)3--血 红色 | |
| D. | 用标准酸性KMnO4溶液滴定NaHSO3溶液以测量其浓度:KMnO4--紫红色 |
| A. | Cl2与H2O反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 往FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+ | |
| C. | 向AlCl3溶液中滴加氨水至过量:Al3++3OH-═Al(OH)3↓ | |
| D. | 将铜片投入浓硝酸中:2NO3-+Cu+4H+═Cu2++2NO2↑+2H2O |
| W | X | Y |
| Z |
| A. | 四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W) | |
| B. | 四种元素形成的单质最多有6种 | |
| C. | X与Y形成的气态化合物超过两种 | |
| D. | 四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
| A. | 日常生活中的陶瓷、水泥、玻璃等是使用量最大的无机非金属材料 | |
| B. | 制饭勺、高压锅等的不锈钢是合金.合金有许多优良的性能,如熔点比成分金属高 | |
| C. | 防止或减少雾霾形成的措施之一是减少煤的燃烧和机动车的使用 | |
| D. | 食品干燥剂应无毒、无味、无腐蚀性及环境友好,硅胶可用作食品干燥剂 |
| A. | A、B、C分别与D形成的化合物的热稳定性依次减弱 | |
| B. | B、D原子构成的一种分子B2D4只含有极性共价单键 | |
| C. | B、C、D三种元素可以形成酸、碱或者盐三种物质 | |
| D. | C的离子半径小于E的离子半径 |