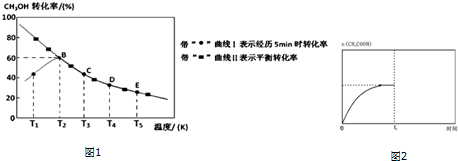
题目内容
6.下表是元素周期表的一部分,针对表中的①~=10 ⑩种元素,填写下列空白:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 第2周期 | ① | ② | ③ | |||||
| 第3周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第4周期 | ⑨ | ⑩ |
(2)在①~⑩元素中,金属性最强的元素是K(填元素符号),气态氢化物能与其最高价氧化物对应的水化物发生反应生成盐的元素是N(填元素符号).
(3)元素⑥与元素⑦相比,⑦的非金属性较强,下列表述中能证明这一事实的是bd.
a.常温下⑥的单质和⑦的单质状态不同
b.⑦的氢化物比⑥的氢化物稳定
c.一定条件下⑥和⑦的单质都能与氢氧化钠溶液反应
d.一定条件下⑥和⑦的单质与Fe反应的产物不同
(4)⑤的单质可以与⑨的最高价氧化物的水化物的溶液反应,若将该反应设计成原电池,其负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O.
分析 由元素在周期表的位置可知,①~⑩元素分别为C、N、O、Mg、Al、S、Cl、Ar、K、Ca;
(1)由上述分析可知元素的名称;
(2)K的金属性最强,N的气态氢化物能与其最高价氧化物对应的水化物发生反应生成盐为铵盐;
(3)利用氢化物的稳定性、与变价金属反应、最高价含氧酸等比较非金属性;
(4)设计成原电池,Al在负极失去电子生成偏铝酸根离子.
解答 解:由元素在周期表的位置可知,①~⑩元素分别为C、N、O、Mg、Al、S、Cl、Ar、K、Ca;
(1)元素的名称⑧为氩气,⑩为钙,故答案为:氩;钙;
(2)在①~⑩元素中,金属性最强的元素是K,气态氢化物能与其最高价氧化物对应的水化物发生反应生成盐的元素是N,故答案为:K;N;
(3)a.常温下⑥的单质和⑦的单质状态不同,为物理性质,不能比较非金属性,故不选
b.⑦的氢化物比⑥的氢化物稳定,可知非金属性,故选;
c.一定条件下⑥和⑦的单质都能与氢氧化钠溶液反应,为物质的特性,不能比较非金属性,故不选;
d.一定条件下⑥和⑦的单质与Fe反应的产物不同,可知得电子的难易,故选;
故答案为:bd;
(4)⑤的单质可以与⑨的最高价氧化物的水化物的溶液反应,若将该反应设计成原电池,其负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O,故答案为:Al-3e-+4OH-=AlO2-+2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
16.下列分散系不发生丁达尔效应的是( )
| A. | 碘溶于酒精配成碘酒 | B. | 雾 | ||
| C. | Fe(OH)3胶体 | D. | 含有灰尘颗粒的空气 |
1.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)C的离子结构示意图为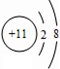 ,I的原子结构示意图
,I的原子结构示意图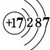 .
.
(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为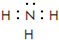 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
(3)元素的最高价氧化物对应的水化物中,碱性最强的是NaOH,该碱化学键类型离子键和共价键,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G H形成的化合物的稳定性顺序为:CH4<NH3<H2O<HF.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | B | ||||||
| 2 | D | E | F | G | ||||
| 3 | C | H | I |
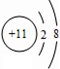 ,I的原子结构示意图
,I的原子结构示意图 .
.(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
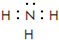 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).(3)元素的最高价氧化物对应的水化物中,碱性最强的是NaOH,该碱化学键类型离子键和共价键,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G H形成的化合物的稳定性顺序为:CH4<NH3<H2O<HF.
16.向蔗糖中加入浓硫酸,现象如图所示.关于该实验的说法中不正确的是( )


| A. | 蔗糖变黑体现了浓硫酸的脱水性 | |
| B. | 蔗糖体积膨胀变成疏松多孔的海绵状物质炭 | |
| C. | 实验中有大量气体产生体现了浓硫酸的强酸性 | |
| D. | 将产生的气体通入品红溶液,溶液会褪色 |


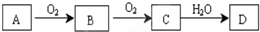
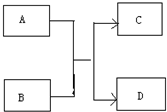 运用有关知识,回答下列问题.
运用有关知识,回答下列问题.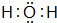 ,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.
,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.