题目内容
18.已知C、H2、CO的燃烧热的数据如表所示:| 物质 | C | H2 | CO |
| △H(kJ/mol) | -393.5 | -285.8 | -283.0 |
(2)能表示H2燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.kJ/mol.
(3)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为应该选择A(填写序号).
A.H2 B.CO C.均可以
理由是相同体积的氢气与一氧化碳完全燃烧氢气放出热量多.
分析 (1)碳完全燃烧生成二氧化碳的反应,标注物质聚集状态和对应反应的焓变;
(2)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,计算1molH2完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式;
(3)相同条件下,相同体积的氢气与一氧化碳完全燃烧比较相同物质的量的气体燃烧反应放出的热量进行比较,然后进行选择.
解答 解:(1)碳完全燃烧生成二氧化碳的反应,标注物质聚集状态和对应反应的焓变,C完全燃烧的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
故答案为:C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol;
(2)H2的燃烧热为285.8kJ/mol,则1molH2在氧气中完全燃烧放出的热量为285.8kJ,因此H2燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8kJ/mol
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.kJ/mol;
(3)相同条件下,相同体积的氢气与一氧化碳完全燃烧比较相同物质的量的气体燃烧反应放出的热量比较,氢气燃烧热285.8KJ.一氧化碳燃烧热为283.0KJ,所以氢气放出热量多,
故答案为:A;相同体积的氢气与一氧化碳完全燃烧氢气放出热量多.
点评 本题考查了热化学方程式的书写原则和方法应用,燃烧热概念的应用,掌握热化学方程式的书写方法以及燃烧热的概念是解答关键,题目较简单.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
10.某兴趣小组的同学三次实验测得钢质容器中1L水的温度变化如表所示(水的比热容c=4.18J•g-1•℃-1):
①1.2g碳完全燃烧放出的热量为37.62KJ.
②写出碳完全燃烧的热化学方程式:C(s)+O2(g)=CO2(g)△H=-376.2KJ/mol.
| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 33.8 |
| ② | 24.7 | 33.7 |
| ③ | 24.9 | 35.9 |
②写出碳完全燃烧的热化学方程式:C(s)+O2(g)=CO2(g)△H=-376.2KJ/mol.
7.下列在指定条件下的各组离子,一定能大量共存的是( )
| A. | pH=13的溶液:K+、AlO2-、Cl-、S2- | |
| B. | 含有大量CO32-的溶液:Na+、Ca2+、Cl-、OH- | |
| C. | 含有大量SCN -的溶液:Na+、NH4+、Fe3+、Cl- | |
| D. | 水电离产生的c(H+)水=10-12mol•L-1的溶液:K+、Na+、Ca2+、ClO- |
8.有机物分子中原子间(或者原子与原子团间)的相互影响会导致其化学性质的不同.下列各项事实不能说明上述观点的是( )
| A. | 苯酚能和氢氧化钠溶液反应,而乙醇不能和氢氧化钠溶液反应 | |
| B. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯能发生加成反应,而乙烷不能发生加成反应 |
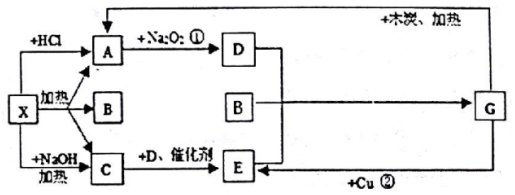
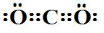 ;G的化学式为HNO3.
;G的化学式为HNO3.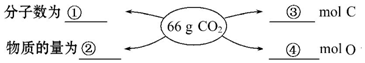
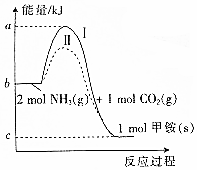 氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示.
氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2与NH3反应生成甲铵的能量变化如图所示. (1)氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
(1)氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.