题目内容
3. (1)氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
(1)氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.①硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2.
已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol-1
则H2还原NO2生成水蒸气反应的热化学方程式是4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol.ⅠⅡ
②利用ClO2氧化氮氧化物反应过程如下:NO$→_{Ⅰ}^{ClO_{2}}$NO2$→_{Ⅱ}^{Na_{2}SO_{3}溶液}$N2
反应Ⅰ的化学方程式是2NO+ClO2+H2O═NO2+HNO3+HCl,反应Ⅱ的化学方程式是2NO2+4Na2SO3=N2+4Na2SO4.若有11.2LN2生成(标准状况),共消耗ClO267.5 g.
③工业废气中含有的NO2还可用电解法消除.用NO2为原料可制新型绿色硝化剂N2O5.制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示.Pt(甲)为阳极(填“阴”或“阳”),电解池中生成N2O5的电极反应式是N2O4+2HNO3-2e-=2N2O5+2H+.
分析 (1)①已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol ①
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol ②
由盖斯定律将①×2-②可得热化学方程式;
②二氧化氮具有氧化性,亚硫酸钠具有还原性,根据氧化还原反应的规律知识来回答判断;据N2~2NO2~2ClO2中氮气的量来分析;
③由N2O4制取N2O5需要失去电子,所以N2O5在阳极区生成,即Pt甲为阳极,Pt乙为阴极.
解答 解:(1)①已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol ①
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol ②
由盖斯定律可知,①×2-②得4H2(g)+2NO2(g)=N2(g)+4H2O(g),故△H=2×(-483.6kJ/mol)-67.7kJ/mol=-1034.9kJ/mol,
故热化学方程式为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol,
故答案为:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1034.9kJ/mol;
②二氧化氮具有氧化性,亚硫酸钠具有还原性,二者之间会发生氧化还原反应,故方程式为2NO2+4Na2SO3=N2+4Na2SO4;再结合化学反应2NO+ClO2+H2O=NO2+HNO3+HCl知道,N2~2NO2~2ClO2,所以若生成标准状况下22.4LN2,则n( N2 )=$\frac{11.2L}{22.4L/mol}$=0.5mol,则消耗1molClO2,质量m=nM=1mol×67.5g/mol=67.5g,
故答案为:2NO2+4SO32-=N2+4SO42-; 67.5;
③从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,故生成N2O5的Pt甲为阳极,Pt乙为阴极,生成N2O5的反应式为N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阳;N2O4+2HNO3-2e-=2N2O5+2H+.
点评 本题涉及热化学方程式、化学方程式书写、化学计算、电解原理等知识点,题目难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| 物质 | C | H2 | CO |
| △H(kJ/mol) | -393.5 | -285.8 | -283.0 |
(2)能表示H2燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.kJ/mol.
(3)现以H2或CO为燃料来提供热能,从热能的角度考虑,你认为应该选择A(填写序号).
A.H2 B.CO C.均可以
理由是相同体积的氢气与一氧化碳完全燃烧氢气放出热量多.
| A. | F | B. | O | C. | Ne | D. | He |
| A. | 电池的电解液为碱性溶液,负极为Fe | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH减小 | |
| D. | 电池充电时,OH-向阳极迁移 |
 +H2C=CH2$\stackrel{一定条件}{→}$
+H2C=CH2$\stackrel{一定条件}{→}$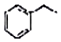
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$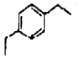
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$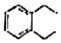
 .
.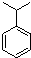 ,N:
,N: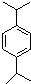 .
. 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.