题目内容
14.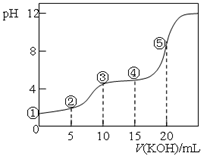 常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
常温下,用0.10mol•L-1 KOH溶液滴定 10.00mL 0.10mol•L-1H2C2O4(二元弱酸)溶液 所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )| A. | 点①所示溶液中:c(H+)/c(OH-)=1012 | |
| B. | 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| C. | 点③所示溶液中:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05mol•L-1 | |
| D. | 点⑤所示溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
分析 A.0.10mol•L-1 H2C2O4(二元弱酸)不能完全电离,点①pH≠1;
B.点②为混合溶液,由电荷守恒分析;
C.由物料守恒分析;
D.点③溶液显酸性,等体积等浓度反应生成KHC2O4,电离大于其水解.
解答 解:A.0.10mol•L-1 H2C2O4(二元弱酸)不能完全电离,点①pH≠1,则$\frac{c({H}^{+})}{c(O{H}^{-})}$≠1012,故A错误;
B.点②为混合溶液,由电荷守恒可知,c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故B错误;
C.点③所示溶液中草酸与KOH溶液的体积相同,含碳微粒的总浓度变为原来的一半,由物料守恒可知,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05mol•L-1,故C正确;
D.点③溶液显酸性,等体积等浓度反应生成KHC2O4,电离大于其水解,则c(K+)>c(HC2O4-)>c(H+)>c(OH-),故D错误;
故选C.
点评 本题考查酸碱混合溶液的定性判断及离子浓度的关系,注意草酸为弱酸,明确电荷守恒、物料守恒即可解答,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列环境问题主要与SO2有关的是( )
| A. | 温室效应 | B. | 臭氧空洞 | C. | 酸雨 | D. | 光化学烟雾 |
5.下列能正确表示Mg的原子结构示意图的是( )
| A. |  | B. |  | C. |  | D. |  |
2.下列有关金属的说法正确的是( )
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 金属导电的实质是金属阳离子在外电场作用下的定向移动 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2 |
9.NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.6NA | |
| B. | 60 g SiO2晶体中含有2NA个Si-O键 | |
| C. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
19.假设反应N2+3H2?2NH3(正反应为放热反应) 的正反应速率是v1,逆反应速率是v2,当升高温度时,v1和v2的变化情况为( )
| A. | 同时增大 | B. | v1减小,v2增大 | C. | 同时减小 | D. | v1增大,v2减小 |
4.下列关于液氯和氯水的叙述中正确的是( )
| A. | 液氯是纯净物,而氯水是混合物 | B. | 液氯有酸性,氯水有漂白性 | ||
| C. | 液氯较氯水的漂白作用更强 | D. | 液氯无色,氯水呈黄绿色 |

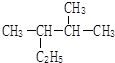 2,3-二甲基戊烷
2,3-二甲基戊烷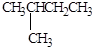

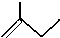 C5H10
C5H10 名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol.
名称是环十二烷,1mol该烃完全燃烧,需消耗氧气18mol.