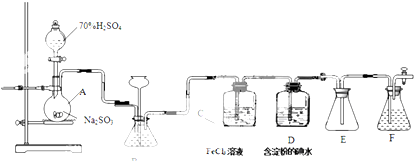
题目内容
某工厂利用褐煤烟灰(主要成分为碳、二氧化锗,还有少量氧化铝和二氧化硅)制取纯GeO2的主要流程如下:
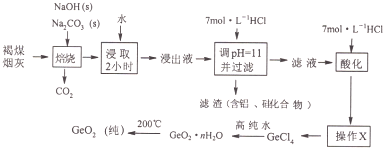
已知:GeO2是一种难溶于水的偏弱酸性的两性氧化物,GeCl4的沸点是83.1℃.
(1)写出二氧化锗与碳酸钠焙烧时发生反应的化学方程式: .
(2)用水浸取焙烧物长达2小时的目的是 .
(3)“酸化”至溶液中盐酸浓度为5.3mol?L-1时有利于生成四氯化锗,写出该反应的化学方程式 .
(4)若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是 .
(5)操作“X”的名称为 .
(6)四氯化锗与高纯水反应的化学方程式为 .

已知:GeO2是一种难溶于水的偏弱酸性的两性氧化物,GeCl4的沸点是83.1℃.
(1)写出二氧化锗与碳酸钠焙烧时发生反应的化学方程式:
(2)用水浸取焙烧物长达2小时的目的是
(3)“酸化”至溶液中盐酸浓度为5.3mol?L-1时有利于生成四氯化锗,写出该反应的化学方程式
(4)若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是
(5)操作“X”的名称为
(6)四氯化锗与高纯水反应的化学方程式为
考点:制备实验方案的设计,物质的分离、提纯和除杂
专题:实验题
分析:(1)根据题干信息可以判断:反应物为GeO2、Na2CO3,生成物为Na2GeO3、CO2,反应条件为加热,据此写出反应的化学方程式;
(2)水浸取焙烧物的时间较长,可以使焙烧物中含锗化合物尽可能溶解;
(3)类比偏铝酸钠与盐酸的反应,根据题干信息判断反应物、生成物,然后写出反应的化学方程式;
(4)如果酸度不够,锗酸钠与氢离子反应生成了生成了H2GeO3(或GeO2或GeO2?nH2O),生成了H2GeO3(或GeO2或GeO2?nH2O)水中溶解度不大,所以出现浑浊现象;
(5)溶液中分离易溶物,可以根据沸点不同利用蒸馏法分离;
(6)根据反应流程可知,四氯化锗与高纯水反应生成GeO2?nH2O,根据质量守恒定律写出该反应方程式.
(2)水浸取焙烧物的时间较长,可以使焙烧物中含锗化合物尽可能溶解;
(3)类比偏铝酸钠与盐酸的反应,根据题干信息判断反应物、生成物,然后写出反应的化学方程式;
(4)如果酸度不够,锗酸钠与氢离子反应生成了生成了H2GeO3(或GeO2或GeO2?nH2O),生成了H2GeO3(或GeO2或GeO2?nH2O)水中溶解度不大,所以出现浑浊现象;
(5)溶液中分离易溶物,可以根据沸点不同利用蒸馏法分离;
(6)根据反应流程可知,四氯化锗与高纯水反应生成GeO2?nH2O,根据质量守恒定律写出该反应方程式.
解答:
解:(1)根据反应流程可知,碳酸钠与二氧化锗反应生成锗酸钠和二氧化碳,反应的化学方程式为:GeO2+Na2CO3
Na2GeO3+CO2↑,
故答案为:GeO2+Na2CO3
Na2GeO3+CO2↑;
(2)用水浸取焙烧物长达2小时的目的是为了尽可能使焙烧混合物中的含锗化合物溶于水,=从而提高含锗化合物的浸出率,
故答案为:为了提高含锗化合物的浸出率;
(3)GeO2是一种难溶于水的偏弱酸性的两性氧化物,类比氢氧化铝的性质,则H2GeO3能够与氯化氢反应生成生成物为GeCl4、NaCl和水,反应的化学方程式为:Na2GeO3+6HCl=2NaCl+3H2O+GeCl4,
故答案为:Na2GeO3+6HCl=2NaCl+3H2O+GeCl4;
(4)若滤液“酸化”时酸度不够,Na2GeO3与氢离子反应生成了生成了H2GeO3(或GeO2或GeO2?nH2O),生成了H2GeO3(或GeO2或GeO2?nH2O)在水中溶解度较小,所以溶液会出现明显的浑浊,
故答案为:生成了H2GeO3(或GeO2或GeO2?nH2O)沉淀;
(5)GeCl4的沸点是83.1℃,其沸点较低,从溶液中分离出GeCl4,可以通过蒸馏操作操作完成,
故答案为:蒸馏;
(6)根据制备流程可知,GeCl4与高纯水反应生成GeO2?nH2O,另一种产物为HCl,则反应的化学方程式为:GeCl4+(2+n)H2O=4HCl+GeO2?nH2O,
故答案为:GeCl4+(2+n)H2O=4HCl+GeO2?nH2O.
| ||
故答案为:GeO2+Na2CO3
| ||
(2)用水浸取焙烧物长达2小时的目的是为了尽可能使焙烧混合物中的含锗化合物溶于水,=从而提高含锗化合物的浸出率,
故答案为:为了提高含锗化合物的浸出率;
(3)GeO2是一种难溶于水的偏弱酸性的两性氧化物,类比氢氧化铝的性质,则H2GeO3能够与氯化氢反应生成生成物为GeCl4、NaCl和水,反应的化学方程式为:Na2GeO3+6HCl=2NaCl+3H2O+GeCl4,
故答案为:Na2GeO3+6HCl=2NaCl+3H2O+GeCl4;
(4)若滤液“酸化”时酸度不够,Na2GeO3与氢离子反应生成了生成了H2GeO3(或GeO2或GeO2?nH2O),生成了H2GeO3(或GeO2或GeO2?nH2O)在水中溶解度较小,所以溶液会出现明显的浑浊,
故答案为:生成了H2GeO3(或GeO2或GeO2?nH2O)沉淀;
(5)GeCl4的沸点是83.1℃,其沸点较低,从溶液中分离出GeCl4,可以通过蒸馏操作操作完成,
故答案为:蒸馏;
(6)根据制备流程可知,GeCl4与高纯水反应生成GeO2?nH2O,另一种产物为HCl,则反应的化学方程式为:GeCl4+(2+n)H2O=4HCl+GeO2?nH2O,
故答案为:GeCl4+(2+n)H2O=4HCl+GeO2?nH2O.
点评:本题通过纯GeO2的制备流程,考查了物质制备方案的设计方法,题目难度中等,试题中书写化学方程式的知识点较多,解答关键是根据制备流程正确判断反应物、生成物,然后利用质量守恒定律书写出方程式即可,试题有利于培养学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
相关题目
下列有关化学反应速率的说法中,正确的是( )
| A、100mL2mol?L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B、用铁片和稀硫酸反应制氢气时,改用铁片和浓硫酸反应可增大反应物浓度,所以可以加快产生氢气的速率 |
| C、二氧化硫的催化氧化是一个放热反应,升高温度,反应活化能降低,反应速率加快 |
| D、汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,活化分子百分数不变,反应速率减小 |
下列叙述不正确的是( )
| A、与28 g CO具有相同分子数的CO2的质量一定是44 g |
| B、在标准状况下,11.2 L某气体的质量为22 g,则该气体的相对分子质量是44 g/mol |
| C、16 g O2和16 g O3含的氧原子个数一样多 |
| D、1 L 1 mol?L-1Fe(OH)3胶体中胶体微粒数目小于NA |
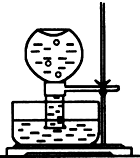 (1)如图所示,现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是(请用相关的反应方程式和简要文字说明)
(1)如图所示,现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是(请用相关的反应方程式和简要文字说明)