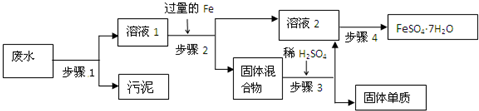
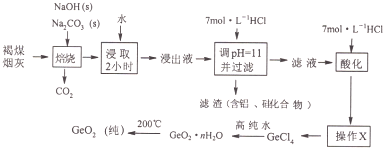
题目内容
某溶液中可能含有大量下列阴离子:OH-、SO42-、CO32-、Cl-.
(1)当溶液中存在大量H+时,则溶液中不可能有 .
(2)当溶液中有大量的Ba2+存在时,则溶液中不可能有 ,用离子方程式写出不可能存在的原因 , .
(1)当溶液中存在大量H+时,则溶液中不可能有
(2)当溶液中有大量的Ba2+存在时,则溶液中不可能有
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:(1)离子之间结合生成水、气体的不能大量共存;
(2)离子之间结合生成沉淀的不能大量共存.
(2)离子之间结合生成沉淀的不能大量共存.
解答:
解:(1)当溶液中存在大量H+时,H+与OH-、CO32-分别反应,则不能大量共存,故答案为:OH-、CO32-;
(2)当溶液中有大量的Ba2+存在时,因Ba2+分别与SO42-、CO32-反应生成沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓、Ba2++CO32-=BaCO3↓则不能共存,
故答案为:SO42-、CO32-;Ba2++SO42-=BaSO4↓;Ba2++CO32-=BaCO3↓.
(2)当溶液中有大量的Ba2+存在时,因Ba2+分别与SO42-、CO32-反应生成沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓、Ba2++CO32-=BaCO3↓则不能共存,
故答案为:SO42-、CO32-;Ba2++SO42-=BaSO4↓;Ba2++CO32-=BaCO3↓.
点评:本题考查离子的共存,熟悉复分解反应发生的条件即可解答,题目较简单.

练习册系列答案
相关题目
下列关于溶液和胶体的叙述,正确的是( )
| A、溶液呈电中性,胶体带电 |
| B、用一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
| C、溶液中的分散质粒子能透过滤纸,胶体中分散质粒子不能透过滤纸 |
| D、将FeCl3溶液滴加到沸水中,长时间加热煮沸就可制得Fe(OH)3 |
下列说法正确的是( )
| A、35Cl和37Cl互为同素异形体 | ||||
| B、O2和O3是氧元素的两种同位素 | ||||
| C、35Cl和37Cl中35、37表示的是质量数 | ||||
D、1
|
下列有关实验原理、方法和结论都正确的是( )
| A、某无色溶液滴加氯水和CCl4,振荡、静置分层后,下层溶液显紫色,则原溶液中有I- |
| B、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含SO42- |
| D、某无色溶液用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液含有Na+无K+ |