题目内容
某兴趣小组探究SO2气体还原Fe,I2,他们使用的药品和装置如如所示.
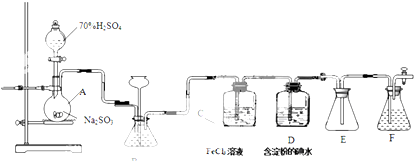
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若 ,则整个装置气密性良好.装置E的作用是 .装置F中为 溶液.
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 .
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是 (填离子符号).
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是 ,原因是 .
(5)能表明I-的还原性弱于SO2的现象是 ,写出有关离子方程式: .

(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是
(5)能表明I-的还原性弱于SO2的现象是
考点:性质实验方案的设计,探究二氧化硫与水和品红溶液的反应
专题:实验设计题
分析:(1)利用液面差在一段时间内不变检验装置的气密性;有缓冲装置能防止倒吸;二氧化硫有毒不能直接排空,应该用碱液吸收;
(2)二氧化硫能溶于水生成亚硫酸,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气;
(3)二氧化硫具有还原性、铁离子具有氧化性,二者发生氧化还原反应生成硫酸根离子和亚铁离子;
(4)亚铁离子和KSCN溶液不反应,但能被氯水氧化生成铁离子,铁离子和KSCN溶液反应生成血红色溶液;亚硫酸钡和稀盐酸反应,二氧化硫和亚铁离子都和酸性高锰酸钾溶液反应;
(5)同一可逆反应中,还原剂的还原性大于还原产物的还原性,根据D中溶液颜色变化判断.
(2)二氧化硫能溶于水生成亚硫酸,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气;
(3)二氧化硫具有还原性、铁离子具有氧化性,二者发生氧化还原反应生成硫酸根离子和亚铁离子;
(4)亚铁离子和KSCN溶液不反应,但能被氯水氧化生成铁离子,铁离子和KSCN溶液反应生成血红色溶液;亚硫酸钡和稀盐酸反应,二氧化硫和亚铁离子都和酸性高锰酸钾溶液反应;
(5)同一可逆反应中,还原剂的还原性大于还原产物的还原性,根据D中溶液颜色变化判断.
解答:
解:(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,说明不漏气,则气密性良好;
E中左侧为短导管可防止液体倒吸;
F中盛放NaOH溶液进行尾气处理,防止含硫化合物排放在环境中,从而保护环境,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)二氧化硫能溶于水生成亚硫酸,二氧化硫和亚硫酸钠、碳酸氢钠反应,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气,故选C;
(3)二氧化硫具有还原性、铁离子具有氧化性,二者发生氧化还原反应生成硫酸根离子和亚铁离子,
故答案为:Fe2+、SO42-;
(4)方案①往第一份试液中加入KMnO4溶液,紫红色褪去,原来溶液中有二氧化硫,二氧化硫和亚铁离子都能被酸性高锰酸钾溶液氧化而导致酸性高锰酸钾溶液褪色,所以不能确定哪种微粒其作用,故错误;
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红,亚铁离子和KSCN不反应,铁离子和KSCN反应生成血红色溶液,所以可以检验溶液中存在亚铁离子,故正确;
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀,亚硫酸根离子和氯化钡不反应,硫酸根离子和钡离子反应生成硫酸钡沉淀,且不溶于稀盐酸,所以可以检验溶液中存在硫酸根离子,故正确;
所以实验方案①不合理,故答案为:方案①;SO2、Fe2+都能使酸性高锰酸钾褪色;
(5)I2+SO2+2H2O=4H++2I-+SO42-中还原剂是二氧化硫、还原产物是碘离子,所以还原性SO2>I-,碘遇淀粉试液变蓝色,所以看到的现象是D中蓝色褪去,离子反应方程式为I2+SO2+2H2O=4H++2I-+SO42-,
故答案为:D中蓝色褪去;I2+SO2+2H2O=4H++2I-+SO42-.
E中左侧为短导管可防止液体倒吸;
F中盛放NaOH溶液进行尾气处理,防止含硫化合物排放在环境中,从而保护环境,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)二氧化硫能溶于水生成亚硫酸,二氧化硫和亚硫酸钠、碳酸氢钠反应,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气,故选C;
(3)二氧化硫具有还原性、铁离子具有氧化性,二者发生氧化还原反应生成硫酸根离子和亚铁离子,
故答案为:Fe2+、SO42-;
(4)方案①往第一份试液中加入KMnO4溶液,紫红色褪去,原来溶液中有二氧化硫,二氧化硫和亚铁离子都能被酸性高锰酸钾溶液氧化而导致酸性高锰酸钾溶液褪色,所以不能确定哪种微粒其作用,故错误;
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红,亚铁离子和KSCN不反应,铁离子和KSCN反应生成血红色溶液,所以可以检验溶液中存在亚铁离子,故正确;
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀,亚硫酸根离子和氯化钡不反应,硫酸根离子和钡离子反应生成硫酸钡沉淀,且不溶于稀盐酸,所以可以检验溶液中存在硫酸根离子,故正确;
所以实验方案①不合理,故答案为:方案①;SO2、Fe2+都能使酸性高锰酸钾褪色;
(5)I2+SO2+2H2O=4H++2I-+SO42-中还原剂是二氧化硫、还原产物是碘离子,所以还原性SO2>I-,碘遇淀粉试液变蓝色,所以看到的现象是D中蓝色褪去,离子反应方程式为I2+SO2+2H2O=4H++2I-+SO42-,
故答案为:D中蓝色褪去;I2+SO2+2H2O=4H++2I-+SO42-.
点评:本题考查性质实验方案设计,侧重考查学生对实验方案的设计、评价,明确物质性质是解本题关键,注意(4)题为易错点,同时考查学生思维的缜密性,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
现有三组溶液:①汽油和水 ②酒精和水 ③氯化钠的水溶液.分离以上各混合液的正确方法依次是( )
| A、分液、萃取、蒸馏 |
| B、萃取、蒸馏、分液 |
| C、分液、蒸馏、蒸发 |
| D、蒸馏、萃取、分液 |
下列实验操作中不正确的是( )
| A、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口附近 |
| B、蒸发操作时,应使混合物的水分完全蒸干后才能停止加热 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、萃取操作时,应选择有机萃取剂,它与原溶剂应互不相溶 |
 用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中正确的是( )
 ,有机物甲的结构简式为
,有机物甲的结构简式为 ,它是由不饱和烃乙的两个分子在一定条件下自身加成得到,在此反应中除生成甲外,还同时生成另一种产量更高的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体.
,它是由不饱和烃乙的两个分子在一定条件下自身加成得到,在此反应中除生成甲外,还同时生成另一种产量更高的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体.

 ):
):