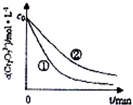
题目内容
下列有关化学反应速率的说法中,正确的是( )
| A、100mL2mol?L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B、用铁片和稀硫酸反应制氢气时,改用铁片和浓硫酸反应可增大反应物浓度,所以可以加快产生氢气的速率 |
| C、二氧化硫的催化氧化是一个放热反应,升高温度,反应活化能降低,反应速率加快 |
| D、汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,活化分子百分数不变,反应速率减小 |
考点:化学反应速率的影响因素
专题:
分析:对于化学反应,增大浓度、升高温度、加入催化剂以及增大固体的表面积可增大反应速率,结合选项中所给信息解答该题.
解答:
解:A.加入氯化钠溶液,溶液体积增大,氢离子浓度减小,则反应速率减小,故A错误;
B.浓硫酸具有强氧化性,与锌反应生成二氧化硫气体,而不生成氢气,故B错误.
C.升高温度对反应速率的影响是增多单位体积内活化分子数增多,正逆反应速率都增大,故C错误;
B.减小压强,活化分子百分数不变,但是压强减小,反应速率减小,故D正确;
故选:D.
B.浓硫酸具有强氧化性,与锌反应生成二氧化硫气体,而不生成氢气,故B错误.
C.升高温度对反应速率的影响是增多单位体积内活化分子数增多,正逆反应速率都增大,故C错误;
B.减小压强,活化分子百分数不变,但是压强减小,反应速率减小,故D正确;
故选:D.
点评:本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
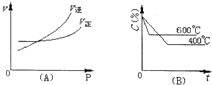 如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
如图中C%表示某反应物在体系中的百分含量,图(A)为温度一定时压强与反应速度的关系曲线.图(B)为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )| A、N2O3(g)?NO2(g)+NO(g)△H>0 |
| B、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 |
| C、3NO2(g)+H2O(I)?2HNO3(I)+NO(g)△H<0 |
| D、CO2(g)+C(s)?2CO(g)△H>0 |
下列各组离子在指定溶液中,一定能大量共存的是( )
| A、加入KSCN显红色的溶液中:Na+、Cu2+、Cl-、I- |
| B、c(CO32-)=0.1mol/L的溶液中:K+、Na+、Cl-、I- |
| C、c(H+)/c(OH-)=1012的溶液中:NH4+、Fe2+、NO3-、SO42- |
| D、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
若用NA表示阿伏伽德罗常数的值,则下列说法错误的是( )
| A、71gCl2变为Cl-可失去2NA个电子 |
| B、标准状况下1molN2和SO2的混合物的体积约占22.4L |
| C、NA个O2和NA个H2的质量比为16:1 |
| D、常温常压下4g氦气含NA个氦原子 |
关于反映4Al+3TiO2+3C═2Al2O3+3TiC的叙述正确的是( )
| A、Al是还原剂,TiC是氧化产物 |
| B、TiO2是氧化剂,TiC是还原产物 |
| C、反应中氧化剂与还原剂的物质的量之比是1:1 |
| D、生成1molTiC时转移4mol电子 |
下列关于溶液和胶体的叙述,正确的是( )
| A、溶液呈电中性,胶体带电 |
| B、用一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
| C、溶液中的分散质粒子能透过滤纸,胶体中分散质粒子不能透过滤纸 |
| D、将FeCl3溶液滴加到沸水中,长时间加热煮沸就可制得Fe(OH)3 |