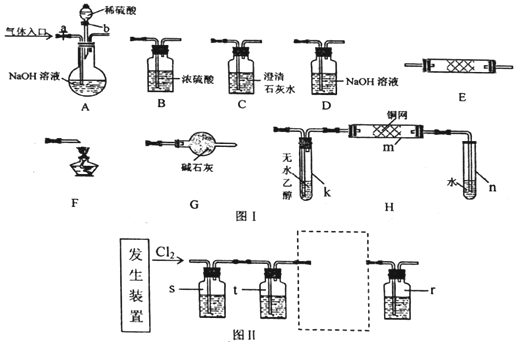
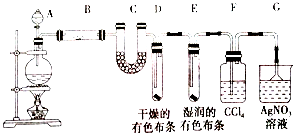
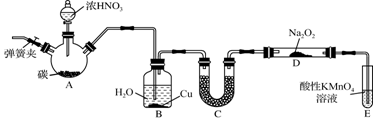
题目内容
11. 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )| A. | X、Y、Z元素的离子半径大小是X>Y>Z | |
| B. | x元素的氢化物沸点比同主族元素的氢化物低 | |
| C. | Y与Q和W与Q元素形成的化合物化学键类型相同 | |
| D. | q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的 |
分析 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,0.1mol•L-1D溶液的pH为1,D为HCl,D是由W与Q形成的化合物,W为H,Q为Cl;B是两性氢氧化物,则B为Al(OH)3,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性,A为NaAlO2;结合转化可知C为AlCl3,再结合原子序数可知,X为O,Y为Na,Z为Al,以此来解答.
解答 解:由上述分析可知,W为H,X为O,Y为Na,Z为Al,Q为Cl,
A.具有相同电子排布的离子中,原子序数大的离子半径小,则X、Y、Z元素的离子半径大小是X>Y>Z,故A正确;
B.水分子间含氢键,则X元素的氢化物沸点比同主族元素的氢化物高,故B错误;
C.Y与Q形成NaCl中含离子键,W与Q元素形成HCl含共价键,故C错误;
D.Q的最高价氧化物对应的水化物为高氯酸,酸性最强,而氢化物的酸性小于HBr、HI酸,故D错误;
故选A.
点评 本题考查无机物的推断,为高频考点,把握焰色反应、pH计算、两性氢氧化物推断物质为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,D为HCl、B为氢氧化铝为推断的突破口,题目难度不大.

练习册系列答案
相关题目
1.由氧化亚铁、氧化铁、四氧化三铁组成的混合物ag,加入bmol/L的稀硫酸cL时固体恰好完全溶解.若将ag该混合物在足量的一氧化碳中加热充分反应,冷却后固体质量为( )
| A. | 16bc克 | B. | (a-16bc)克 | C. | (a-32bc)克 | D. | 无法计算 |
2.制取甲烷的反应为C(s)+2H2(g)?CH4(g)△H>0,欲提高反应的速率和H2的转化率,可采用的措施为( )
| A. | 压缩容器体积 | B. | 降温 | ||
| C. | 增大C(s)的量 | D. | 恒温恒压时加入一定量H2 |
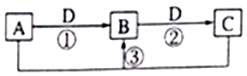
16.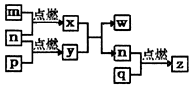 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:a<b<c<d | B. | 氢化物的沸点:b>d | ||
| C. | x的电子式为: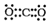 | D. | z、w含有的化学键类型完全相同 |
14.将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.得到如表中的两组数据:下列说法不正确的是( )
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | 实验1在前6min的平均反应速率υ(SO2)=0.2 mol•L-1•min-1 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | x=1.6,y=0.2,t<6 |