题目内容
16.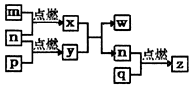 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小:a<b<c<d | B. | 氢化物的沸点:b>d | ||
| C. | x的电子式为: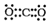 | D. | z、w含有的化学键类型完全相同 |
分析 短周期主族元素,a、b、c、d的原子序数依次增大.四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一,z为SO2,q为S,d为S元素;25℃0.01mol•L-1w溶液中,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1.0×10-10,w为强碱溶液,则w为NaOH,结合原子序数及图中转化可知,a为H,b为O,c为Na,x为H2O,y为Na2O2,以此来解答.
解答 解:由上述分析可知,a为H,b为O,c为Na,d为S,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径的大小:a<b<d<c,故A错误;
B.水分子间含氢键,氢化物的沸点:b>d,故B正确;
C.x为H2O,其电子式为 ,故C错误;
,故C错误;
D.z为SO2,只含共价键,而w为NaOH,含离子键、共价键,故D错误;
故选B.
点评 本题考查无机物的推断,为高频考点,把握元素化合物知识、物质的转化推断物质及元素为解答的关键,侧重分析与推断能力的考查,注意酸雨、w为NaOH为推断的突破口,题目难度不大.

练习册系列答案
相关题目
6.下列各项内容,排列顺序正确是( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②常见离子的还原性排序:S2->I->Fe2+
③微粒半径:K+>S2->F-
④给出质子的能力:CH3COOH>C2H3OH>H2O
⑤氢化物的沸点:H2Se>H2S>H2O.
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②常见离子的还原性排序:S2->I->Fe2+
③微粒半径:K+>S2->F-
④给出质子的能力:CH3COOH>C2H3OH>H2O
⑤氢化物的沸点:H2Se>H2S>H2O.
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③⑤ |
7.符合化学式C7H8O的芳香族化合物的同分异构体有x种,能与金属钠反应放出H2的有y种,能与NaOH反应的有z种,则x、y、z分别是( )
| A. | 5,4,3 | B. | 4,4,3 | C. | 4,3,3 | D. | 3,3,3 |
4.浊液区别于其它分散系本质的特征是( )
| A. | 外观浑浊不清 | B. | 分散系粒子直径大于100nm | ||
| C. | 不稳定 | D. | 不能发生丁达尔现象 |
11.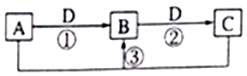 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )| A. | X、Y、Z元素的离子半径大小是X>Y>Z | |
| B. | x元素的氢化物沸点比同主族元素的氢化物低 | |
| C. | Y与Q和W与Q元素形成的化合物化学键类型相同 | |
| D. | q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的 |
1.下列叙述中正确的是( )
| A. | 第ⅠA族元素都是典型的金属元素 | |
| B. | 过渡元素都是金属元素 | |
| C. | 任何元素的原子都是由核外电子和核内质子、中子所组成 | |
| D. | 均属“镧系元素”的镧(57La)与铈(58Ce)互为同位素 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 6.2g白磷中所含P-P键的数目为0.15NA | |
| B. | 含H2O2 3.4克的溶液完全分解,其电子转移数目为NA | |
| C. | 117g氯化钠固体含有2NA个氯化钠分子 | |
| D. | 6克金刚石含NA个C-C键 |
19.根据题意回答下列问题:
某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0,5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
(1)已知盐酸、NaOH溶液密度近似为1.00g•cm-3,中和后混合液的比热容c=4.18×10-3kJ•g-1•℃-1,则该反应的中和热为△H=-55.7 kJ•mol-1.
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收热量,造成测得中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏大(填“偏大”、“偏小”或“不变”).
某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55mol•L-1,盐酸的浓度为0,5mol•L-1,每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
| 3 | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”、“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收热量,造成测得中和热偏小.
(3)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热偏大(填“偏大”、“偏小”或“不变”).
 纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而备受关注,下表为制取纳米级Cu2O的三种方法: