题目内容
1.由氧化亚铁、氧化铁、四氧化三铁组成的混合物ag,加入bmol/L的稀硫酸cL时固体恰好完全溶解.若将ag该混合物在足量的一氧化碳中加热充分反应,冷却后固体质量为( )| A. | 16bc克 | B. | (a-16bc)克 | C. | (a-32bc)克 | D. | 无法计算 |
分析 氧化物与硫酸反应生成硫酸盐和水,金属氧化物中n(O)=n(H2SO4),等量金属与CO反应生成金属单质,则金属单质的质量为混合物质量减去氧元素的质量,以此来解答.
解答 解:混合物ag,加入bmol/L的稀硫酸cL时固体恰好完全溶解,n(H2SO4)=cL×bmol/L=cbmol,
氧化物与硫酸反应生成硫酸盐和水,金属氧化物中n(O)=n(H2SO4)=cbmol,
将ag该混合物在足量的一氧化碳中加热充分反应,冷却后固体质量为ag-cbmol×16g/mol=(a-16cb)g,
故选B.
点评 本题考查混合物的计算,为高频考点,把握氧元素的质量计算为解答的关键,侧重分析计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
11.在100℃时,3.88g 的气体A与足量的Na2O2反应,可放出氧气,且固体的质量增加了2.28g,由此可知,A的组成为( )
| A. | 只有水蒸气 | B. | 只有二氧化碳 | ||
| C. | 水蒸气和二氧化碳 | D. | 无法确定 |
12.下列说法正确的是( )
| A. | 电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离 | |
| B. | 电解质在通电时发生电离 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | NaCl和HCl都是电解质,所以它们熔融状态下都能导电 |
9.下列有关实验的叙述中正确的是( )
| A. | 能够便甲基橙变黄的溶液一定为碱性溶液 | |
| B. | 以KI溶液为标准溶液滴定未知浓度的FeCl3溶液,可选用淀粉溶液作为指示剂 | |
| C. | 使用量程为50mL的滴定管测量溶液体积时,开始时读数为21.00mL,将滴定管中剩余液体全部放出,则所得溶液体积大于29.00mL | |
| D. | 盛待测定的滴定管,第一次读数平视凹液面最低处,第二次仰视,则所测待测液浓度偏高 |
16.已知CuCl2呈棕色,易溶于水及乙醇和丙酮,其水合物受热分解如下:2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Cu(OH)2•CuCl2+2HCl↑+2H2O↑.则下列有关叙述中错误的是( )
| A. | CuCl2具有一定的氧化性 | |
| B. | 电解CuCl2水溶液时,阳极一定得到Cu单质 | |
| C. | Cu(OH)2•CuCl2 属于碱式盐 | |
| D. | 制备无水CuCl2时,需要在HCl气流中加热脱水 |
6.下列各项内容,排列顺序正确是( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②常见离子的还原性排序:S2->I->Fe2+
③微粒半径:K+>S2->F-
④给出质子的能力:CH3COOH>C2H3OH>H2O
⑤氢化物的沸点:H2Se>H2S>H2O.
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②常见离子的还原性排序:S2->I->Fe2+
③微粒半径:K+>S2->F-
④给出质子的能力:CH3COOH>C2H3OH>H2O
⑤氢化物的沸点:H2Se>H2S>H2O.
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③⑤ |
13.观察下列几个装置示意图,有关叙述正确的是( )
| A. | 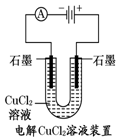 装置中阳极上析出红色固体 | |
| B. | 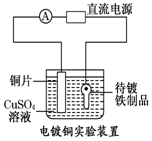 装置的待镀铁制品应与电源正极相连 | |
| C. | 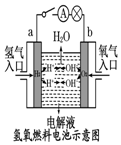 装置中外电路电子由a极流向b极 | |
| D. | 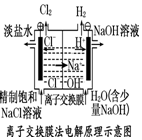 装置的阳极反应为:2H++2e-=H2↑ |
10.下列物质属于芳香烃,但不是苯的同系物的是( )


| A. | ③④ | B. | ②⑤ | C. | ①②⑤⑥ | D. | ②③④⑤⑥ |
11.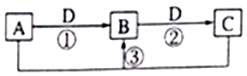 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )| A. | X、Y、Z元素的离子半径大小是X>Y>Z | |
| B. | x元素的氢化物沸点比同主族元素的氢化物低 | |
| C. | Y与Q和W与Q元素形成的化合物化学键类型相同 | |
| D. | q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的 |