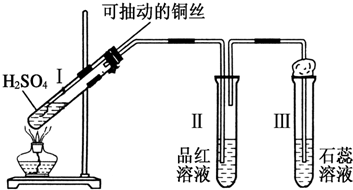
题目内容
2.某化合物由硫和铁两种元素组成.6g该化合物在氧气中燃烧,并使其中的硫经过一系列变化最终全部转化为硫酸,用200ml 1mol/L的烧碱溶液恰好能完全中和这些酸.通过计算,写出该化合物的化学式.分析 根据n=cV计算NaOH的物质的量,根据关系式为S~SO2~H2SO4~2NaOH计算S原子物质的量,再计算Fe原子的物质的量,进而确定化学式.
解答 解:n(NaOH)=0.02L×1mol/L=0.02mol,
由反应的关系式:S~SO2~H2SO4~2NaOH可知,n(S)=$\frac{1}{2}$n(NaOH)=0.02mol×$\frac{1}{2}$=0.01mol,
则硫和铁组成的化合物中m(S)=0.01mol×32g/mol=0.32g,则Fe的质量为0.6g-0.32g=0.28g,
则n(Fe)=$\frac{0.28g}{56g/mol}$=0.005mol,所以n(Fe):n(S)=0.005:0.01=1:2,即铁的硫化物的化学式为FeS2;
答:该化合物的化学式为FeS2.
点评 本题考查化学方程式有关计算,涉及多步反应的计算,注意利用关系式的进行解答,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
17.α-铁纳米粉在现代电子工业上用途极为广泛,用赤铁矿石(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备纳米铁颗粒的实验流程如下:
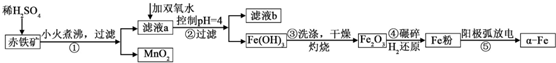
已知:部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
(1)步骤②中用pH试纸测定溶液pH的操作是将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照.步骤②滤液中含有的金属阳离子是Cu2+、Al3+,步骤④中碾碎的目的是增大接触面积,提高原料的转化率和反应速率.
(2)将第①步过滤所得的MnO2与KClO3、KOH溶液共热,可得到K2MnO4,此反应的化学方程式是3MnO2+6KOH+KClO3=3 K2MnO4+KCl+3H2O.
(3)步骤③灼烧所需的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳.
(4)若步骤⑤是利用电弧加热使金属熔融蒸发成蒸汽,使大量颗粒状烟灰尘与周围X气体原子激烈碰撞进行充分的能量交换和电荷交换生成α-Fe,X气体可以为c.
a.O2b.N2c.Hed.H2
(5)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式3Fe+2O2$\frac{\underline{\;撞击\;}}{\;}$Fe3O4.

已知:部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
(2)将第①步过滤所得的MnO2与KClO3、KOH溶液共热,可得到K2MnO4,此反应的化学方程式是3MnO2+6KOH+KClO3=3 K2MnO4+KCl+3H2O.
(3)步骤③灼烧所需的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳.
(4)若步骤⑤是利用电弧加热使金属熔融蒸发成蒸汽,使大量颗粒状烟灰尘与周围X气体原子激烈碰撞进行充分的能量交换和电荷交换生成α-Fe,X气体可以为c.
a.O2b.N2c.Hed.H2
(5)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式3Fe+2O2$\frac{\underline{\;撞击\;}}{\;}$Fe3O4.
17.向0.4mol/L 500mL的石灰水中通入SO2气体,得12g白色沉淀,则SO2的体积可能为( )
| A. | 2.24L或4.48L | B. | 2.24L或6.72L | C. | 4.48L或8.96L | D. | 6.72L或8.96L |
7.下列对葡萄糖的叙述中,正确的是( )
| A. | 能与新制氢氧化铜反应 | B. | 能发生水解反应放出热量 | ||
| C. | 不能发生酯化反应 | D. | 是白色晶体难溶于水 |
14.下列有关实验说法正确的是( )
| A. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 | |
| B. | 做“食醋总酸含量的测定”实验时,必须先将市售食醋稀释10倍,然后用洗净的酸式滴定管量取一定体积的稀释液于洁净的锥形瓶中,锥形瓶不需要先用醋酸溶液润洗 | |
| C. | 铁钉镀锌前,先要用砂纸打磨直至表面变得光滑,然后放入45℃的浓盐酸中浸泡2min,再取出用水洗净 | |
| D. | 在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再各加一小块(绿豆大小)吸干煤油的金属钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
12.工业上利用氢气在氯气中燃烧,将所得产物溶于水制备盐酸.有人设想利用原电池原理直接制备盐酸的同时获取电能,假设这种想法可行,下列说法肯定错误的是( )
| A. | 两极材料都用金属铂,用一定浓度的盐酸做电解质溶液 | |
| B. | 通入氯气的电极为原电池的正极 | |
| C. | 该方法可将化学能完全转化为电能 | |
| D. | 通氢气的电极发生的反应为:H2→2H++2e- |
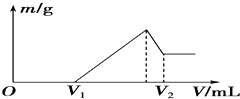 0.1mol的镁、铝混合物溶于100mL 2mol•L-1H2SO4溶液中,然后再滴加1mol•L-1NaOH溶液.请回答:
0.1mol的镁、铝混合物溶于100mL 2mol•L-1H2SO4溶液中,然后再滴加1mol•L-1NaOH溶液.请回答: