题目内容
11.X、Y、W为常见的四种单质,常温下X是固体,Y是液体,Z是无色气体,W为黄绿色气体.其反应关系如下,其中B的溶液显强酸性.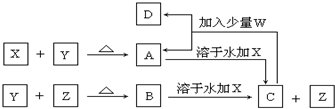
(1)根据反应推断X、Y、Z的化学式:XFe,YBr2,ZH2
(2)指出X的元素在元素周期表中的位置:第四周期第Ⅷ族
(3)写出A溶于水后加入X的离子方程式:Fe+2Fe3+=3Fe2+
(4)写出C与过量W反应的离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-.
分析 W为黄绿色气体单质,则W为Cl2,X为固体,结合X与Y反应生成A,C与氯气反应生成A和D,A与X反应生成C,可知X应为变价金属Fe,由B的溶液显强酸性,可知Y为Br2,X与Y反应生成A为FeBr3,Z是无色气体单质,可知Z为H2,B为HBr,C为FeBr2,C与氯气反应生成A、D,D为FeCl3,以此来解答.
解答 解:W为黄绿色气体单质,则W为Cl2,X为固体,结合X与Y反应生成A,C与氯气反应生成A和D,A与X反应生成C,可知X应为变价金属Fe,由B的溶液显强酸性,可知Y为Br2,X与Y反应生成A为FeBr3,Z是无色气体单质,可知Z为H2,B为HBr,C为FeBr2,C与氯气反应生成A、D,D为FeCl3,
(1)由上述分析可知,X、Y、Z分别为Fe、Br2、H2,故答案为:Fe;Br2;H2;
(2)X的元素的原子序数为26,在元素周期表中的位置为第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(3)A溶于水后加入X的离子方程式为Fe+2Fe3+=3Fe2+,故答案为:Fe+2Fe3+=3Fe2+;
(4)C与过量W反应的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故答案为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的氧化还原反应、元素化合物知识为解答的关键,侧重分析与推断能力的考查,注意A、X、Y均为推断的突破口,题目难度中等.

练习册系列答案
相关题目
1.下列式子为分子式的是( )
| A. | NH4Cl | B. | Cu | C. | SiO2 | D. | I2 |
19.如图实验装置和试剂的选用或操作都正确的是( )
| A. |  除去NO中的NO2 | B. |  铁制品表面镀锌 | C. |  稀释浓硫酸 | D. |  制备少量O2 |
16.关于如图装置图的叙述中,不正确的是( )
| A. | 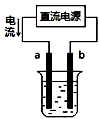 用装置精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 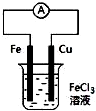 装置的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 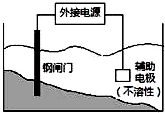 装置中钢闸门应与外接电源的负极相连 | |
| D. | 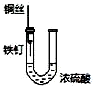 装置中的发生的是铁钉的析氢腐蚀 |
3.第28届国际地质大会提供的资料显示,海底蕴藏着大量的天然气水合物,俗称“可燃冰”.“可燃冰”是一种晶体,晶体中平均每46 个H2O 分子构建成8 个笼,每个笼可容纳1个CH4分子或1个游离的H2O 分子.若晶体中每8 个笼有6 个容纳了CH4分子,另外2个笼被游离H2O分子填充.则“可燃冰”的平均组成可表示为( )
| A. | 3CH4•H2O | B. | CH4•3H2O | C. | CH4•6H2O | D. | CH4•8H2O |
20.下列有关物质的性质或应用的说法不正确的是( )
| A. | 二氧化硅是生产光纤制品的基本原料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | D${\;}_{2}^{16}$O中,质量数之和是质子数之和的两倍 | |
| D. | 石油分馏可获得乙烯、丙烯和丁二烯 |
1.下列有关苯的叙述中错误的是( )
| A. | 苯在催化剂作用下能与液溴发生取代反应 | |
| B. | 在一定条件下苯能与氯气发生加成反应 | |
| C. | 在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色 | |
| D. | 在苯中加入溴水,振荡并静置后下层液体为橙色 |