题目内容
12.工业上利用氢气在氯气中燃烧,将所得产物溶于水制备盐酸.有人设想利用原电池原理直接制备盐酸的同时获取电能,假设这种想法可行,下列说法肯定错误的是( )| A. | 两极材料都用金属铂,用一定浓度的盐酸做电解质溶液 | |
| B. | 通入氯气的电极为原电池的正极 | |
| C. | 该方法可将化学能完全转化为电能 | |
| D. | 通氢气的电极发生的反应为:H2→2H++2e- |
分析 由信息可知,利用原电池原理直接制盐酸的电池反应为H2+Cl2=2HCl,该原电池的工作原理和燃料电池的工作原理相似,氢气为负极,氯气为正极,化学能转化为电能,以此来解答.
解答 解:A.两极材料可以都用金属铂(惰性电极),一极通入氢气,一极通入氯气,可以用稀盐酸做电解质溶液,故A正确;
B.通氯气的电极为正极,发生得电子得还原反应,电极反应式为Cl2+2e-=2Cl-,故B正确;
C.为原电池中,该方法可将化学能转化为电能,能量转化率较高,但不能完全转化,故C错误;
D.反应H2+Cl2=2HCl中,氢气失电子,所以通入氢气的电极为原电池的负极,负极反应为H2-2e-=2H+,故D正确;
故选C.
点评 本题考查原电池及工作原理,为高频考点,把握原电池的工作原理、电极反应、能量转化等为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.

练习册系列答案
相关题目
3.第28届国际地质大会提供的资料显示,海底蕴藏着大量的天然气水合物,俗称“可燃冰”.“可燃冰”是一种晶体,晶体中平均每46 个H2O 分子构建成8 个笼,每个笼可容纳1个CH4分子或1个游离的H2O 分子.若晶体中每8 个笼有6 个容纳了CH4分子,另外2个笼被游离H2O分子填充.则“可燃冰”的平均组成可表示为( )
| A. | 3CH4•H2O | B. | CH4•3H2O | C. | CH4•6H2O | D. | CH4•8H2O |
20.下列有关物质的性质或应用的说法不正确的是( )
| A. | 二氧化硅是生产光纤制品的基本原料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | D${\;}_{2}^{16}$O中,质量数之和是质子数之和的两倍 | |
| D. | 石油分馏可获得乙烯、丙烯和丁二烯 |
17.下列物质只需克服范德华力,就可改变状态的是( )
| A. | 液态氮 | B. | 氯化钠晶体 | C. | 液态汞 | D. | 金刚石 |
4.在无土栽培中,需配制一定量含0.3molKCl、0.2molK2SO4和0.1mol ZnSO4的营养液.若用KCl、K2SO4、ZnCl2三种固体为原料来配制此营养液,三者的物质的量依次是( )
| A. | 0.3、0.1、0.2 | B. | 0.2、0.3、0.1 | C. | 0.1、0.2、0.3 | D. | 0.1、0.3、0.1 |
1.下列有关苯的叙述中错误的是( )
| A. | 苯在催化剂作用下能与液溴发生取代反应 | |
| B. | 在一定条件下苯能与氯气发生加成反应 | |
| C. | 在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色 | |
| D. | 在苯中加入溴水,振荡并静置后下层液体为橙色 |
2.从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
甲: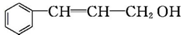 乙:
乙: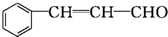
丙:
请回答下列问题:
(1)甲中含氧官能团的名称为羟基.
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
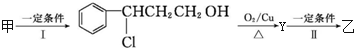
其中反应Ⅰ的类型为加成反应,反应Ⅱ的化学方程式为 (注明反应条件).
(注明反应条件).
(3)已知:RCH=CHR'$→_{ii.Zn/H_{2}O}^{i.O_{3}}$RCHO+R'CHO;2HCHO$\underset{\stackrel{i.浓NaOH}{→}}{ii.{H}^{+}}$HCOOH+CH3OH.
由乙制丙的一种合成路线如图所示(A~F均为有机物,图中Mr表示相对分子质量):
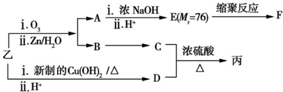
①下列物质不能与C反应的是c(填序号).
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②E的结构结构简式:HOCH2COOH
③写出反应方程式C+D→丙: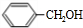 +
+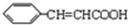 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ 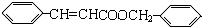 +H2O
+H2O
④D有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体的结构简式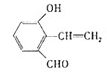 .
.
a.苯环上连接三种不同的官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色.
甲:
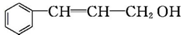 乙:
乙: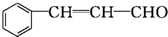
丙:
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀硫酸中水解 |
(1)甲中含氧官能团的名称为羟基.
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
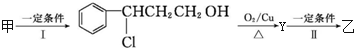
其中反应Ⅰ的类型为加成反应,反应Ⅱ的化学方程式为
 (注明反应条件).
(注明反应条件).(3)已知:RCH=CHR'$→_{ii.Zn/H_{2}O}^{i.O_{3}}$RCHO+R'CHO;2HCHO$\underset{\stackrel{i.浓NaOH}{→}}{ii.{H}^{+}}$HCOOH+CH3OH.
由乙制丙的一种合成路线如图所示(A~F均为有机物,图中Mr表示相对分子质量):

①下列物质不能与C反应的是c(填序号).
a.金属钠 b.HBr c.Na2CO3溶液 d.乙酸
②E的结构结构简式:HOCH2COOH
③写出反应方程式C+D→丙:
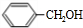 +
+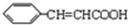 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ 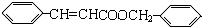 +H2O
+H2O④D有多种同分异构体,任写其中一种能同时满足下列条件的同分异构体的结构简式
 .
.a.苯环上连接三种不同的官能团 b.能发生银镜反应
c.能与Br2/CCl4发生加成反应 d.遇FeCl3溶液显示特征颜色.