题目内容
6.一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:氧化反应为Cu-2e-═Cu2+,还原反应为2Fe3++2e-═2Fe2+,原电池的电极反应式也可利用此方法书写.请回答下列问题:(1)微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电池总反应为Ag2O+Zn=2Ag+ZnO,据此判断Ag2O是 极,电极反应式为Ag2O+2e-+H2O=2Ag+2OH;Zn是负 极,电极反应式为Zn-2e-+2OH-=ZnO+H2O.放电时,电解质溶液中OH---移向负极.
(2)有人以化学反应:2Zn+O2+4H+═2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作.则该原电池负极的电极反应式为2Zn-4e-═2Zn2+,正极的电极反应式为O2+4H++4e-═2H2O,若电池工作过程中有5.6L O2(标准状况下)参于反应,则转移电子的物质的量为1mol.
分析 (1)电池是将化学能转化为电能的装置,原电池中负极上失电子发生氧化反应,正极上得电子发生还原反应,在得失电子相等的条件下,将正负电极上电极反应式相加即得电池反应式;
(2)根据电池反应式知,锌失电子发生氧化反应而作负极,氧气在正极得电子发生还原反应,根据电极反应式计算.
解答 解:(1)根据电池总反应为Ag2O+Zn=2Ag+ZnO,据此判断Ag2O是正极,电极反应式为Ag2O+H2O+2e-=2Ag+2OH-;Zn是负极,电极反应式为Zn+2OH--2e-=ZnO+H2O,电解质溶液中OH-移向负极,
故答案为:正;Ag2O+2e-+H2O=2Ag+2OH-;负;Zn-2e-+2OH-=ZnO+H2O;负;
(2)根据电池反应式知,锌失电子发生氧化反应,所以锌作负极,电极反应式为:2Zn-4e-═2Zn2+,氧气在正极得电子发生还原反应,电极反应式为:O2+4H++4e-═2H2O,若电池工作过程中有5.6L O2(标准状况下)即$\frac{5.6L}{22.4L/mol}$=0.25mol参于反应,则转移电子的物质的量为0.25mol×4=1mol;
故答案为:2Zn-4e-═2Zn2+;O2+4H++4e-═2H2O;1mol.
点评 本题考查原电池以及氢氧燃料电池的工作原理,注意电解质溶液的酸碱性不同,则电极反应不同,根据得失电子判断正负极,难点是电极反应式的书写,难度不大.

练习册系列答案
相关题目
11.下列关于氯水的叙述中正确的是( )
| A. | 新制氯水中只含有Cl2和H2O两种物质 | |
| B. | 新制氯水可以使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,逸出的气体只有氯气 | |
| D. | 氯水放置数天后酸性减弱 |
18.使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应全部生成C2H2Cl4,则两个过程中消耗的氯气的总物质的量是( )
| A. | 3 mol | B. | 4 mol | C. | 5 mol | D. | 6 mol |
15.将30mL0.5mol/L NaOH 溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量为( )
| A. | 0.03mol/L | B. | 0.3mol/L | C. | 0.015mol | D. | 0.25 mol |
14.下列说法不符合ⅦA族元素性质特征的是( )
| A. | 最高价都为+7 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下非金属性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
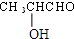
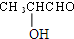 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$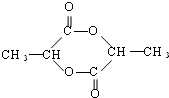 +2 H2O
+2 H2O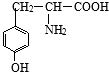 有一种结构简式如图的有机物,请回答下列问题:
有一种结构简式如图的有机物,请回答下列问题: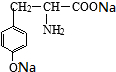 +2H2O.
+2H2O.