题目内容
7.在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )| A. | 容器内压强不随时间变化 | |
| B. | v正(X)=v逆(Z) | |
| C. | 容器内X、Y、Z的浓度之比为l:2:2 | |
| D. | 单位时间内消耗0.1 mol X的同时生成0.2 mol Z |
分析 由X(g)+2Y(g)?2Z(g)可知,该反应前后的化学计量数之和不相等,然后根据达到平衡时,正逆反应速率相等,但不等于零,各物质的浓度不再改变来解答.
解答 解:A、该反应前后的化学计量数之和不相等,容器内的压强不随时间改变,能确定达到平衡,故A正确;
B、v正(X)=v逆(Z)不能说明正逆反应速率相等,不能说明到达平衡状态,故B错误;
C、X、Y、Z的浓度大小决定于开始加入的多少,与平衡状态无关,故B错误;容器内X、Y、Z的浓度之比为l:2:2,不能说明到达平衡状态,故C错误;
D、单位时间内消耗0.1 mol X 为正速率,同时生成0.2 molZ为正速率,都是正速率不能说明达到平衡状态,故D错误;
故选A.
点评 本题考查化学平衡状态的判断,题目难度不大,做题时注意分析化学方程式的前后计量数大小的关系.

练习册系列答案
相关题目
18.使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应全部生成C2H2Cl4,则两个过程中消耗的氯气的总物质的量是( )
| A. | 3 mol | B. | 4 mol | C. | 5 mol | D. | 6 mol |
15.将30mL0.5mol/L NaOH 溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量为( )
| A. | 0.03mol/L | B. | 0.3mol/L | C. | 0.015mol | D. | 0.25 mol |
12.某溶液中含如下离子组中的若干种:K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色,下列说法正确的是( )
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色,下列说法正确的是( )
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| C. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| D. | 为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
19.在标准状况下盛满HCl气体的烧瓶,将烧瓶倒置于水中,使水充满烧瓶,如果氯化氢均溶解在烧瓶中(假设HCl无损失),所得盐酸的物质的量浓度为( )
| A. | 1mol/L | B. | 0.5mol/L | C. | 0.045mol/L | D. | 0.45mol/L |
14.下列说法不符合ⅦA族元素性质特征的是( )
| A. | 最高价都为+7 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下非金属性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
15.下列说法错误的是( )
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤干馏和石油分馏本质差别是:干馏是化学变化而分馏是物理变化 | |
| D. | 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |


 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$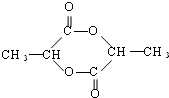 +2 H2O
+2 H2O