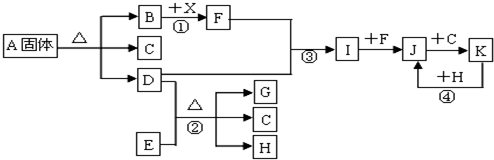
题目内容
19.下列物质性质的变化规律与分子间作用力有关的是( )| A. | HF、HCl、HBr、HI热稳定性依次减弱 | |
| B. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| C. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
分析 A.非金属性越强,对应氢化物越稳定;
B.离子键的键长越短,离子键越强,熔点越高;
C.原子晶体中,共价键的键长越短,熔点越高;
D.分子晶体的相对分子质量越大,沸点越高.
解答 解:A.非金属性F>Cl>Br>I,则HF、HCl、HBr、HI热稳定性依次减弱,与共价键有关,故A不选;
B.离子键的键长越短,离子键越强,熔点越高,则NaF、NaCl、NaBr、NaI的熔点依次降低,与离子键有关,故B不选;
C.原子晶体中,共价键的键长越短,熔点越高,金刚石的硬度大于硅,其熔、沸点也高于硅,与共价键有关,故C不选;
D.分子晶体的相对分子质量越大,沸点越高,则F2、Cl2、Br2、I2的熔、沸点逐渐升高,与分子间作用力有关,故D选;
故选D.
点评 本题考查元素周期律及晶体类型,为高频考点,把握化学键及物质性质的关系为解答的关键,侧重分析与应用能力的考查,注意晶体类型的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列关于氯水的叙述中正确的是( )
| A. | 新制氯水中只含有Cl2和H2O两种物质 | |
| B. | 新制氯水可以使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,逸出的气体只有氯气 | |
| D. | 氯水放置数天后酸性减弱 |
12.某溶液中含如下离子组中的若干种:K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色,下列说法正确的是( )
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色,下列说法正确的是( )
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| C. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| D. | 为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
7.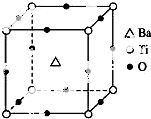 如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )
如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )
 如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )
如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )| A. | 8 BaTi8O12 | B. | 8 BaTi4O9 | C. | 6 BaTiO3 | D. | 3 BaTi2O3 |
14.下列说法不符合ⅦA族元素性质特征的是( )
| A. | 最高价都为+7 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下非金属性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
4.下列化学用语表示正确的是( )
| A. | 钾离子结构示意图: | |
| B. | N2H4的电子式: | |
| C. | 聚丙烯的结构简式: | |
| D. | 中子数为79、质子数为55的铯(Cs)原子:${\;}_{55}^{79}$Cs |
8.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ne(填具体元素符号);非金属性最强的元素是F(填具体元素符号),金属性最强的元素对应的离子结构示意图为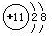 .元素⑩名称为溴.
.元素⑩名称为溴.
(2)在这些元素最高价氧化物对应的水化物中,酸性最强是HClO4(填化学式)
(3)⑦的单质能与NaOH溶液反应,离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
(4)⑧和⑨都是重要的非金属元素.下列叙述能说明⑨的非金属性比⑧强的是bc
a.氢化物的沸点:⑨>⑧b.⑨的单质与氢气化合比⑧的单质容易
c.⑨的单质可置换出⑧的单质 d.⑨的氢化物的酸性比⑧的氢化物的酸性强
(5)元素⑦、⑨形成的化合物中,化学键的类型为共价键.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
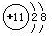 .元素⑩名称为溴.
.元素⑩名称为溴.(2)在这些元素最高价氧化物对应的水化物中,酸性最强是HClO4(填化学式)
(3)⑦的单质能与NaOH溶液反应,离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
(4)⑧和⑨都是重要的非金属元素.下列叙述能说明⑨的非金属性比⑧强的是bc
a.氢化物的沸点:⑨>⑧b.⑨的单质与氢气化合比⑧的单质容易
c.⑨的单质可置换出⑧的单质 d.⑨的氢化物的酸性比⑧的氢化物的酸性强
(5)元素⑦、⑨形成的化合物中,化学键的类型为共价键.