题目内容
1.t℃时,已知0.1mol•L-1HCl溶液中c(OH-)=1×10-11mol•L-1,现将0.2mol•L-1的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=11.分析 t℃时,已知0.1mol•L-1HCl溶液中c(OH-)=1×10-11mol•L-1,而c(H+)=0.1mol/L,据此求出水的离子积Kw=10-12;0.2mol•L-1的硫酸氢钠溶液c(H+)=0.2mol/L,等浓度的氢氧化钡溶液中c(OH-)=0.4mol•L-1,两者混合后碱过量,溶液显碱性,故应求出混合后溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$,然后根据水的离子积求出c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$,然后根据pH=-lgc(H+)来求算.
解答 解:t℃时,0.1mol•L-1HCl溶液中c(OH-)=1×10-11mol•L-1,故此温度下KW=1.0×10-12mol/L.0.2mol•L-1的硫酸氢钠溶液c(H+)=0.2mol/L,等浓度的氢氧化钡溶液中c(OH-)=0.4mol•L-1,两者混合后碱过量,溶液显碱性,故混合后溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$=$\frac{0.4mol/L×VL-0.2mol/L×VL}{2VL}$=0.1mol/L,故溶液中的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-12}}{0.1}$=10-11mol/L,故溶液的pH=-lgc(H+)=11,
故答案为:11.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确溶液pH的概念及计算方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.现有①、②、③三种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p5.则下列有关比较中正确的是( )
①1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p5.则下列有关比较中正确的是( )
| A. | 第一电离能:③>②>① | B. | 原子半径:①>②>③ | ||
| C. | 电负性:③>②>① | D. | 最高正化合价:③>①>② |
9. 可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )
可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )
 可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )
可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )| A. | 若a=1,则A为液体或固体 | |
| B. | 该反应正反应为放热反应 | |
| C. | T2>T1,p2>p1 | |
| D. | 其他条件不变,增加B的物质的量,化学平衡向正反应方向移动,化学平衡常数K增大 |
16.一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)?2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1:2:2
②容器中气体的密度不再发生变化
③容器中气体的压强不再发生变化
④单位时间内生成2n mol Z,同时生成n mol X.
①X、Y、Z的物质的量之比为1:2:2
②容器中气体的密度不再发生变化
③容器中气体的压强不再发生变化
④单位时间内生成2n mol Z,同时生成n mol X.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
11.为了改善空气质最,下列措施不合理的是( )
| A. | 减少化石能源的使用,大力发展太阳能、风能等新能源 | |
| B. | 淘汰落后产能,将污染严重的企业从城市迁往农村 | |
| C. | 控制城市机动车持有量,实行机动车限号行驶 | |
| D. | 倡导绿色化学理念,努力实现“原子经济” |
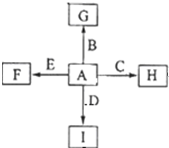 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知: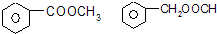 .
.