题目内容
15.食盐和工业用盐具有广泛的用途.已知,工业盐含NaNO2,外观酷似食盐并有咸味.NaNO2有氧化性和还原性,遇酸分解放出NO2.(1)下列试剂可鉴别工业盐和食盐的是bc.
a.H2O b.酸性高锰酸钾溶液 c.盐酸
(2)NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为2NO2-+2I-+4H+=I2+2NO↑+2H2O.
(3)某工厂废液中含有2%-5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2中的氮转化为对空气无污染的气体,该物质是b.
a.NaCl b.NH4Cl c.浓H2SO4
(4)氯碱工业通过电解饱和食盐水来获得相应的产物.请写出电解食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
分析 (1)根据亚硝酸根离子具有还原性的特征反应,可用酸性高锰酸钾溶液鉴别,根据NaNO2遇酸分解放出NO2,可用盐酸鉴别;
(2)根据NO2-的氧化性和I-的还原性,可以写出NO2-与HI反应的离子方程式;
(3)使NaNO2中的氮转化为对空气无污染的气体(氮气),需要另一种反应物具有还原性,只有NH4Cl符合;
(4)电解饱和食盐水,生成氯气、氢气、氢氧化钠.
解答 解:(1)亚硝酸根离子中的氮为+3价,可被酸性高锰酸钾溶液氧化,高锰酸钾褪色,而氯化钠无此现象,可鉴别,NaNO2遇酸分解放出NO2,氯化钠无此现象,可用盐酸鉴别,两种盐都易溶于水,无法用水鉴别,
故选:bc;
(2)根据NO2-的氧化性和I-的还原性,可以写出NO2-与HI反应生成碘单质和一氧化氮,所以离子方程式为2NO2-+2I-+4H+=I2+2NO↑+2H2O,
故答案为:2NO2-+2I-+4H+=I2+2NO↑+2H2O;
(3)因NaNO2转化为不引起污染的N2的过程中N的化合价降低,另一物质化合价必升高,为NH4Cl 中的-3价的氮升高为0价,所以氯化铵符合,
故答案为:b;
(4)电解饱和食盐水,溶液中的氯离子在阳极失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大生成氢氧化钠,反应的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
点评 本题主要结合亚硝酸盐考查了氧化还原反应的知识,考查的方式比较灵活,能较好的体现学生运用知识的能力,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
5.下列物质性质与应用对应关系正确的是( )
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | 氢氟酸具有弱酸性,可用于蚀刻玻璃 | |
| D. | H2O2具有还原性,可用于与酸性高锰酸钾溶液反应制取少量氧气 |
20.下列叙述中,正确的是( )
| A. | 中和10 mL 0.1 mol•L-1 醋酸与中和100 mL 0.01 mol•L-1的醋酸所需同种碱溶液的量不同 | |
| B. | 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液中,由水电离产生的c(OH-)相等 | |
| C. | 向NH4Cl溶液中逐渐加入适量NaOH固体,溶液的导电性明显增强 | |
| D. | 向饱和石灰水中加入少量CaO,恢复至室温后溶液中c(OH-)增大,导电能力增强 |
7.高铁酸钠(Na2FeO4)的氧化性强于高锰酸钾和臭氧,是一种高效多功能净水混凝剂.下面关于高铁酸钠净水作用的叙述不正确的是( )
| A. | Na2FeO4在净水过程中能转变成氢氧化铁 | |
| B. | Na2FeO4能杀菌消毒 | |
| C. | Na2FeO4能除去水中的硫化氢等还原性气体杂质 | |
| D. | Na2FeO4能吸附水中的颜色和固体颗粒 |
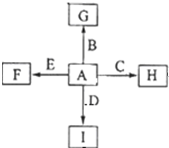 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知: .
.
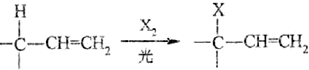
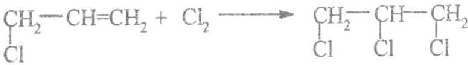 .
.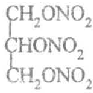 .
.