题目内容
16.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置如表所示;X的单质在氧气中燃烧能生成两种无色气体,Y的最简单气态氢化物的水溶液显碱性.| X | ||
| Z |
(1)元素X在周期表中位于IVA族;W和Z的气态氢化物稳定性比较,其较强的是HCl(填化学式).
(2)W的单质与水反应生成的含氧酸的电子式为
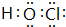
(3)在BaCl2溶液中加入少量Y的最高价氧化物对应水化物溶液,再通入ZO2气体,能生成无色气体YO和白色沉淀BaSO4(填化学式);ZO2和YO还原性比较,其较强的是SO2(填化学式).
分析 X、Y、Z、W是原子序数依次增大的短周期主族元素,Y的最简单气态氢化物的水溶液显碱性,则Y为N元素X的单质在氧气中燃烧能生成两种无色气体,则X为C元素;由X、Z在周期表中的相对位置,可知Z为S元素,故W为Cl.
解答 解:X、Y、Z、W是原子序数依次增大的短周期主族元素,Y的最简单气态氢化物的水溶液显碱性,则Y为N元素X的单质在氧气中燃烧能生成两种无色气体,则X为C元素;由X、Z在周期表中的相对位置,可知Z为S元素,故W为Cl.
(1)元素X为C元素,在周期表中位于第IVA族;非金属性Cl>S,故氢化物稳定性HCl>H2S,
故答案为:IVA;HCl;
(2)W的单质与水反应生成的含氧酸为HClO,电子式为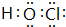 ,
,
故答案为: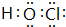 ;
;
(3)在BaCl2溶液中加入少量硝酸,再通入SO2气体,亚硫酸与硝酸反应氧化还原反应得到硫酸与NO,硫酸与氯化钡反应得到BaSO4,说明SO2比NO的强,
故答案为:BaSO4;SO2.
点评 本题考查结构性质位置关系应用,熟练掌握短周期元素,(2)中电子式书写为易错点,容易受化学式影响.

练习册系列答案
相关题目
13.该课外小组设计的从ZnSO4、FeCl3的混合溶液中制取ZnSO4•7H2O过程如下:
a.在混合液中加入6mol•L-1NaOH溶液,至pH=8为止.
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀.
c.向洗涤后的沉淀中加入2mol•L-1的硫酸,保持溶液的pH在4-6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液.
d.滤液中加入2mol•L-1的硫酸,使其pH=2.
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
(1)步骤b中如何检验沉淀已经洗涤干净取最后一次洗涤液少量,滴加硝酸银溶液,若无白色沉淀,说明已经洗涤干净.
(2)步骤d中加入硫酸,使其pH=2的目的是抑制Zn2+的水解; 要制得ZnSO4•7H2O的步骤d还缺少的操作是将溶液加热浓缩、冷却结晶,
所用的主要硅酸盐仪器是蒸发皿、酒精灯、玻璃棒.
a.在混合液中加入6mol•L-1NaOH溶液,至pH=8为止.
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀.
c.向洗涤后的沉淀中加入2mol•L-1的硫酸,保持溶液的pH在4-6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液.
d.滤液中加入2mol•L-1的硫酸,使其pH=2.
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5-3.2 | 6.4-8.0 |
(2)步骤d中加入硫酸,使其pH=2的目的是抑制Zn2+的水解; 要制得ZnSO4•7H2O的步骤d还缺少的操作是将溶液加热浓缩、冷却结晶,
所用的主要硅酸盐仪器是蒸发皿、酒精灯、玻璃棒.
14.化学在生产和日常生活中有着重要的应用.下列说法正确的是( )
| A. | 除去CuSO4溶液中的Fe(SO4)3,加入足量CuO粉末,充分搅拌过滤 | |
| B. | 烧碱、小苏打、氢氧化铝均可用于治疗胃酸过多 | |
| C. | 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 | |
| D. | 铁管道与直流电源正极相连,可缓解管道腐蚀 |
4.下列实验过程中,始终无明显现象的是( )
| A. | O2通入酸化的KI淀粉溶液中 | |
| B. | CO2通入CaCl2溶液中 | |
| C. | 0.1mol•L-l稀H2SO4滴入0.1 mol•L-1Na2S2O3溶液中 | |
| D. | 0.2mol•L-1H2C2O4溶液滴入酸化的KMnO4溶液中 |
5.下列物质性质与应用对应关系正确的是( )
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | 氢氟酸具有弱酸性,可用于蚀刻玻璃 | |
| D. | H2O2具有还原性,可用于与酸性高锰酸钾溶液反应制取少量氧气 |

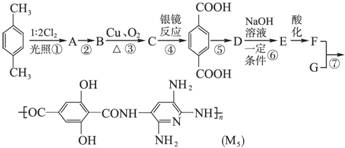
 ,F的含氧官能团的名称有酯基和酚羟基.
,F的含氧官能团的名称有酯基和酚羟基. .
.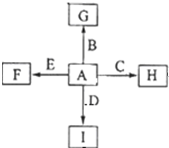 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知: