题目内容
16. 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5mol•L-1 | K1=4.4×10-7mol•L-1 K2=5.6×10-11mol•L-1 | 3.0×10-8 mol•L-1 |
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为CO32->ClO->HCO3->CH3COO-.
(2)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填字母序号,下同).
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-)
D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E. $\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$
若该溶液升高温度,上述5种表达式的数据增大的是ABCE.
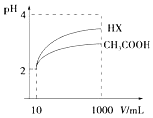
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=11:9.
分析 (1)酸根离子对应酸的酸的电离平衡常数越大,则其结合氢离子能力越弱;
(2)CH3COOH溶液加水稀释过程中,醋酸的电离程度增大,氢离子浓度、醋酸根离子浓度减小,但氢氧根离子浓度增大;由于温度不变,则电离平衡常数、水的离子积不变;升高温度后醋酸的电离程度增大,则溶液中氢离子浓度增大、水的离子积增大、电离平衡常数增大;
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小;
(4)100℃时,水的离子积为1×10-12,c(H+)=10-6mol/L,pH=6,为中性溶液,将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2说明溶液显酸性,计算剩余氢离子浓度列式计算溶液体积比.
解答 解:(1)平衡常数越大,则其结合氢离子能力越弱,由于电离平衡常数CH3COOH>H2CO3>HCO3->HClO,则同浓度CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为:CO32->ClO->HCO3->CH3COO-,
故答案为:CO32->ClO->HCO3->CH3COO-;
(2)A.0.1mol•L-1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小,故A正确;
B.0.1mol•L-1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,故B错误;
C.Kw=c(H+)•c(OH-)只受温度的影响,温度不变则其值是一个常数,故C错误;
D.醋酸稀释,酸性减弱,c(H+)减小,水的离子积不变,则c(OH-)增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$增大,故D错误;
E.$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,故E错误;故选A,
若该溶液升高温度,醋酸、水的电离程度对增大,则溶液中氢离子、氢氧根离子浓度都增大,
A.升高温度后溶液中氢离子浓度c(H+)增大,故A正确;
B.升高温度后氢离子、氢氧根离子浓度都增大,醋酸的浓度减小,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值增大,故B正确;
C.c(H+)•c(OH-)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,故C正确;
D.升高温度后氢氧根离子、氢离子浓度都增大,但氢氧根离子浓度增大的幅度大于氢氧根离子,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$的比值减小,故D错误;
E.$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$为醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,故E正确;故选ABCE,
故答案为:A;ABCE;
(3)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大;HX酸性强于CH3COOH的,稀释后HX溶液中c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱,
故答案为:大于;大于;HX酸性强于CH3COOH的,稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),所以其对水电离的抑制能力也较弱.
(4)100℃时,水的离子积为1×10-12,c(H+)=10-6mol/L,pH=6,为中性溶液,该温度下测得某溶液pH=7,该溶液显碱性,将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2说明溶液显酸性,c(H+)=$\frac{0.1mol/L×aL-bL×\frac{1{0}^{-12}}{1{0}^{-11}}}{aL+bL}$=10-2mol/L,
a:b=11:9,
故答案为:碱; 11:9;
点评 本题考查了弱电解质的电离及其影响,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,明确温度、浓度等对电离平衡常数、水的离子积的影响为解答关键.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案2H2(g)+O2(g)=H2O(g)△H1
2H2(g)+O2(g)=H2O(l)△H2
则△H1和△H2的关系为( )
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1=△H2 | D. | 无法确定 |
| A. | 物质的摩尔质量等于其相对原子(分子)质量 | |
| B. | 物质的量是国际单位制中的一个基本单位 | |
| C. | 0.012㎏12C中所含的碳原子数为NA | |
| D. | 1mol任何物质都含有NA个原子 |
| A. | 乙烯使溴水褪色 | |
| B. | 甲烷与氯气在光照条件下的反应 | |
| C. | 苯和液溴在铁作催化剂的条件下反应 | |
| D. | 乙醇与氧气在铜作催化剂及加热条件下的反应 |
| A. | OH-、NO3-、K+、Na+ | B. | H+、Fe3+、SO42-、Cl- | ||
| C. | K+、Cu2+、Cl-、CO32- | D. | Al3+、Fe2+、NO3-、OH- |
| A. | BeCl2 | B. | H2S | C. | PCl3 | D. | SF4 |
| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400mL | 120mL | 120mL |
| 取乙瓶溶液的量 | 120mL | 440mL | 400mL |
| 生成沉淀的量 | 1.56g | 1.56g | 3.12g |
(2)乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.
| A. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| B. | 铁与稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| D. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ |