题目内容
20.表列出了7种短周期元素在元素周期表中的相对位置,其中元素①的最低负化合价的绝对值与其原子最外层电子数相等,元素⑤是地壳中含量最多的金属元素.| ① | ② | ③ | |||
| ④ | ⑤ | ⑥ | ⑦ |
(1)元素①在元素周期表中所处的位置是第二周期、第ⅣA族.
(2)上述7中元素中,非金属性最强的是O(填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是NaOH.
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是H2O>H2S>SiH4.
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是
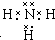 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
分析 元素①的最低负化合价的绝对值与其原子最外层电子数相等,则①为ⅣA族元素,由图中位置可知,应为C元素;元素⑤是地壳中含量最多的金属元素,⑤为Al元素;结合图中7种短周期元素在元素周期表中的相对位置可知,②为N,③为O,④为Na,⑥为Si,⑦为S,
(1)C位于第二周期第ⅣA族;
(2)上述元素中,O元素的非金属性最强,最高价氧化物对应水化物中,氢氧化钠的碱性最强;
(3)非金属性越强,对应氢化物越稳定;
(4)元素④和⑤各自的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠和水;
(5)甲为氨气,甲的水溶液可作刻蚀剂H2O2的清除剂,反应生成氮气和水.
解答 解:元素①的最低负化合价的绝对值与其原子最外层电子数相等,则①为ⅣA族元素,由图中位置可知,应为C元素;元素⑤是地壳中含量最多的金属元素,⑤为Al元素;结合图中7种短周期元素在元素周期表中的相对位置可知,②为N,③为O,④为Na,⑥为Si,⑦为S,
(1)元素①在元素周期表中所处的位置是第二周期、第ⅣA族,故答案为:第二周期、第ⅣA族;
(2)上述7中元素中,非金属性最强的是O;最高价氧化物对应水化物中,碱性最强的物质的化学式是NaOH,故答案为:O;NaOH;
(3)非金属性越强,对应氢化物越稳定,③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是H2O>H2S>SiH4,
故答案为:H2O>H2S>SiH4;
(4)元素④和⑤各自的最高价氧化物对应水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠和水,离子反应为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)化合物甲是元素②形成的最简单氢化物,为氨气,甲的电子式是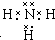 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O,
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O,
故答案为: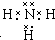 ;2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
;2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
点评 本题考查位置、结构、性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意氢氧化铝为两性氧化物,题目难度不大.

| A. | 铁 | B. | 氧化铜 | C. | 硫酸铜 | D. | 酒精 |
| A. | 在 2 min 内的反应速率,用 C 表示是 0.4 mol/(L•min) | |
| B. | 分别用 B、C、D 表示化学反应速率其比值是 3:2:1 | |
| C. | 达到化学反应限度时,B 物质转化率为 100% | |
| D. | 向容器中增加 A 的投量,可以加快该反应的速率 |
| A. | 单烯烃和环烷烃互为同分异构体 | |
| B. | 分子式相差一个或多个“CH2”的有机物一定互为同系物 | |
| C. | 单烯烃的通式是CnH2n,则二烯烃的通式为CnH2n-2 | |
| D. | n>2时,CnH2n+2的同分异构体比CnH2n的同分异构体多 |
(2)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(3)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
| A. | 乙炔的电子式: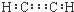 | B. | 对甲基苯酚的结构简式: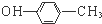 | ||
| C. | 醛基的结构简式:-CHO | D. | 丙烷分子的比例模型为: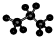 |
| A. | 乙烯常温下是气体,为纯净物;聚乙烯常温下是固体,为混合物 | |
| B. | 可以采用通过溴水洗气的方法以除去乙烷中的乙烯气体 | |
| C. | 乙烯和聚乙烯都能使溴水褪色 | |
| D. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 |
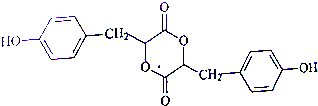
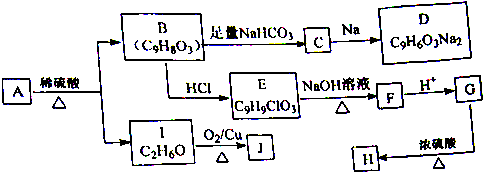
 .
.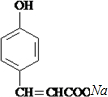 +
+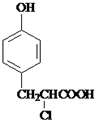 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.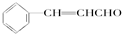 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的: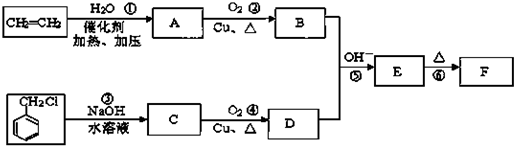
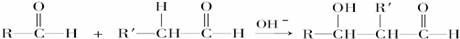
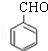 ;
;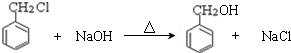 ,判断有关反应的类型:⑥消去反应;
,判断有关反应的类型:⑥消去反应;