题目内容
11.在 2L 的密闭容器中发生反应:4A(s)+3B(g)?2C(g)+D(g),2min后B减小了 1.2mol.有关此反应的说法正确的是( )| A. | 在 2 min 内的反应速率,用 C 表示是 0.4 mol/(L•min) | |
| B. | 分别用 B、C、D 表示化学反应速率其比值是 3:2:1 | |
| C. | 达到化学反应限度时,B 物质转化率为 100% | |
| D. | 向容器中增加 A 的投量,可以加快该反应的速率 |
分析 发生4A(s)+3B(g)?2C(g)+D(g),2min后B减小了1.2mol,v(B)=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol•(L•min)-1,反应速率之比等于化学计量数之比,且升高温度、增大浓度会增大反应速率,正逆反应速率均增大,固体不影响反应速率,可逆反应不能进行彻底,以此来解答.
解答 解:A.在2min内的反应速率,v(B)=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol•(L•min)-1,用C表示是0.2mol•(L•min)-1,故A错误;
B.反应速率之比等于化学计量数之比,则分别用B、C、D表示化学反应速率,其比值是3:2:1,故B正确;
C.达到化学反应限度时,反应达到平衡状态,B 物质转化率一定小于100%,故C错误;
D.A为固体,不能用A表示的反应速率,故错误;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握反应速率的计算、温度对反应速率的影响等为解答的关键,侧重分析与应用能力的考查,注意A为固体在解答中易忽略,题目难度不大.

练习册系列答案
相关题目
2.结构简式为 的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
 的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )
的有机物在一定条件下能和氢气完全加成,加成产物的一溴代物有(不考虑-OH的取代)( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
19.下列关于元素周期表的说法中,正确的是( )
| A. | 元素周期表有 18 个族 | |
| B. | 1-20 号元素称为短周期元素 | |
| C. | 元素周期表中有 7 个主族,7 个副族 | |
| D. | 零族元素原子最外层均为 8 个电子 |
6.下列反应属于吸热反应的是( )
| A. | 盐酸与氢氧化钠溶液的反应 | B. | 生石灰和水的反应 | ||
| C. | 氢气在高温下与氧化铜的反应 | D. | 木炭在氧气中燃烧 |
16.通常情况下,下列各组气体不能共存的是( )
| A. | N2和O2 | B. | H2和Cl2 | C. | H2和O2 | D. | NO和O2 |
20.表列出了7种短周期元素在元素周期表中的相对位置,其中元素①的最低负化合价的绝对值与其原子最外层电子数相等,元素⑤是地壳中含量最多的金属元素.
请用相应的化学用语回答下列问题:
(1)元素①在元素周期表中所处的位置是第二周期、第ⅣA族.
(2)上述7中元素中,非金属性最强的是O(填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是NaOH.
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是H2O>H2S>SiH4.
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是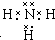 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
| ① | ② | ③ | |||
| ④ | ⑤ | ⑥ | ⑦ |
(1)元素①在元素周期表中所处的位置是第二周期、第ⅣA族.
(2)上述7中元素中,非金属性最强的是O(填元素符号);最高价氧化物对应水化物中,碱性最强的物质的化学式是NaOH.
(3)③、⑥、⑦三种元素形成的简单气态氢化物的稳定性由强到弱的顺序是H2O>H2S>SiH4.
(4)元素④和⑤各自的最高价氧化物对应水化物相互间发生反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O.
(5)化合物甲是元素②形成的最简单氢化物,甲的电子式是
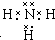 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O. 
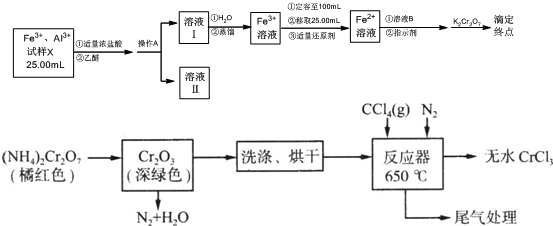
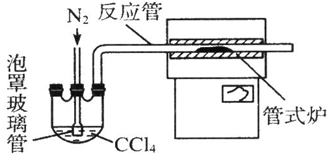
 臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.
臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.