题目内容
2.某同学拟设计如下流程测定铜银合金中铜的质量分数: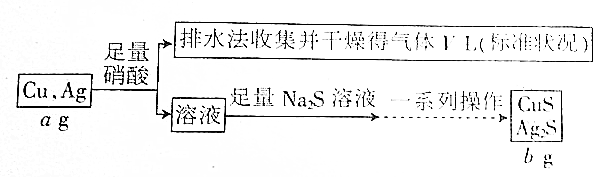
下列说法不正确的是( )
| A. | V L气体是NO | |
| B. | 一系列操作指“过滤、洗涤、烘干” | |
| C. | 上述数据之间的关系有b=$\frac{7a+15v}{7}$ | |
| D. | 根据上述数据能计算合金中铜的质量分数 |
分析 根据流程可知:铜银合金与足量硝酸反应生成硝酸铜、硝酸银溶液、NO或NO2气体,用排水法收集到的VL气体为NO;向反应后的溶液中加入硫化钠溶液,反应生成硫化铜、硫化银沉淀,过滤后得到硫化铜、硫化银固体,然后洗涤、干燥,最后得到干燥的硫化铜、硫化银固体.
解答 解:A.二氧化氮与水反应生成一氧化氮,则用排水法收集到的VL气体为NO,故A正确;
B.根据分析可知,反应生成硫化银沉淀,过滤后得到硫化银固体,然后洗涤、干燥,最后得到干燥的硫化银固体,故B正确;
C.没有告诉硝酸的浓度,合金与硝酸反应放出的气体中可能含有NO2气体,故C错误;
D.根据铜银合金的质量为ag,硫化铜、硫化银的质量为bg,可计算合金中铜的质量分数,故D正确.
故选C.
点评 本题考查化学实验方案的评价,对实验原理的理解、物质组成的测定等,难度中等,理解原理是关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力.

练习册系列答案
相关题目
12.下列离子方程式正确的是( )
| A. | 氯化铁溶液腐蚀铜片:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氯气和烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| C. | 碳酸钙和醋酸反应:CaC03+2H+═CO2↑+Ca2++H2O | |
| D. | 氢氧化铝与稀硫酸反应:Al(OH)3+3H+═3H2O+Al3+ |
13.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸反应的产物,下列有关说法正确的是( )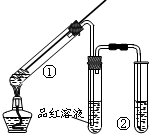

| A. | 品红溶液的作用是吸收SO2,防止污染空气 | |
| B. | 试管②中盛放的试剂通常是NaOH溶液 | |
| C. | 试管①中有白色固体生成,向①中加水后溶液呈蓝色 | |
| D. | 该反应中浓硫酸既表现了强氧化性,又表现了酸性 |
17.下列物质中,既能发生反应既能使溴水褪色,又能使KMnO4酸性溶液褪色的是( )
| A. |  | B. |  | C. |  | D. | CH3CH2OH |
1.(1)用天平称取40.0g NaOH配制500mL 2.0mol•L-1的溶液时,除了烧杯、玻璃棒外,还要使用的玻璃仪器是胶头滴管、500容量瓶.
(2)现有一瓶A和B的混合液,已知它们的性质如下表.
据此分析,将A和B相互分离的常用方法是蒸馏.
(2)现有一瓶A和B的混合液,已知它们的性质如下表.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
2.某氯化镁溶液的密度为1.18g•cm-3,其中镁离子的质量分数为5.1%,500mL该溶液中Cl-的物质的量浓度约等于( )
| A. | 5mol•L-1 | B. | 2.5mol•L-1? | C. | 2.1mol•L-1 | D. | 1.27mol•L-1? |
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大(填越大、越小),K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行的程度越大(填越大、越小),K值大小与温度的关系是:温度升高,K值可能增大也可能减小.(填一定增大、一定减小、或可能增大也可能减小);