题目内容
12.下列离子方程式正确的是( )| A. | 氯化铁溶液腐蚀铜片:Fe3++Cu═Fe2++Cu2+ | |
| B. | 氯气和烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| C. | 碳酸钙和醋酸反应:CaC03+2H+═CO2↑+Ca2++H2O | |
| D. | 氢氧化铝与稀硫酸反应:Al(OH)3+3H+═3H2O+Al3+ |
分析 A.电荷不守恒;
B.二者反应生成氯化钠和次氯酸钠和水;
C.醋酸为弱酸,应保留化学式;
D.二者反应生成硫酸铝和水.
解答 解:A.氯化铁溶液腐蚀铜片,离子方程式:2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.氯气和烧碱溶液反应,离子方程式:Cl2+2OH-═Cl-+ClO-+H2O,故B错误;
C.碳酸钙和醋酸反应,离子方程式:CaC03+2CH3COOH═CO2↑+Ca2++H2O+2CH3COO-,故C错误;
D.氢氧化铝与稀硫酸反应,离子方程式:Al(OH)3+3H+═3H2O+Al3+,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分,注意离子反应遵循客观规律、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中发生反应:N2(g)+O2(g)?2NO(g),下图中曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化(不改变反应物的量).下列叙述正确的是( )

| A. | 曲线a和曲线b表示该反应可能在相同温度下进行 | |
| B. | 曲线b对应的起始反应条件改变是加入了催化剂 | |
| C. | 温度T下,该反应平衡前后混合气体的密度不发生变化 | |
| D. | 温度T下,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{{C}_{0}}^{2}}$ |
3.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 使酚酞呈红色的溶液:K+、Na+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=1×10-10mol•L-1的溶液:Mg2+、NH4+、SO42-、HCO3- | |
| D. | 0.1mol•L-1FeCl3溶液:Fe2+、SO42-、NH4+、SCN- |
20.中国医疗志愿人员采用某种含氯消毒液对非洲埃博拉病毒疫区环境进行消毒,取得良好效果.该含氯消毒液由氯碱工业的产品作为原料制备.据此判断该消毒液的有效成分是( )
| A. | NaClO | B. | Cl2 | C. | NaOH | D. | NaCl |
7.下列有关物质用途的说法错误的是( )
| A. | 过氧化钠用于潜艇供氧 | B. | 氧化铁用做红色颜料 | ||
| C. | 在海轮的外壳上焊接铜板防腐 | D. | 铝制槽车可用来储运浓硫酸 |
4.对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速度,其中反应进行得最快的是( )
| A. | v(A)=0.01mol•L-1•s-1 | B. | v(B)=0.02mol•L-1•s-1 | ||
| C. | v(B)=0.60mol•L-1•min-1 | D. | v(C)=1.00mol•L-1•min-1 |
2.某同学拟设计如下流程测定铜银合金中铜的质量分数:
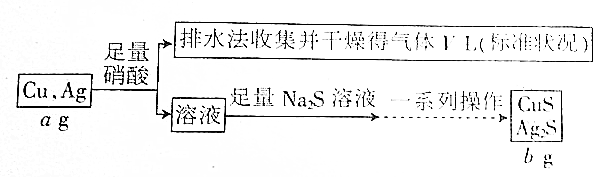
下列说法不正确的是( )

下列说法不正确的是( )
| A. | V L气体是NO | |
| B. | 一系列操作指“过滤、洗涤、烘干” | |
| C. | 上述数据之间的关系有b=$\frac{7a+15v}{7}$ | |
| D. | 根据上述数据能计算合金中铜的质量分数 |
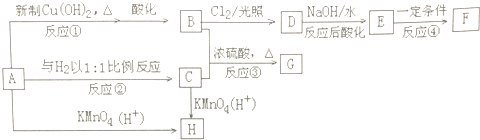
 ,H
,H .
. ;
; .
.
 、
、 .
. )是一种化工产品.请结合题目中有关信息,设计以苯乙烯(
)是一种化工产品.请结合题目中有关信息,设计以苯乙烯(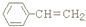 )为原料,制备苯羟乙酸的合成路线(用流程图表示,无机试剂任选).
)为原料,制备苯羟乙酸的合成路线(用流程图表示,无机试剂任选).